题目内容
【题目】某兴趣小组的同学在实验室用含有少量氯化钙的氯化钠固体配制一定质量分数的氯化钠溶液,实验步骤如下图所示:
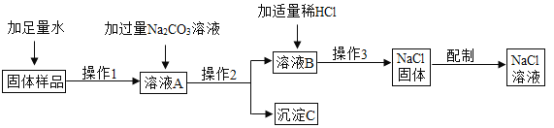
请据图回答:
(1)在“操作2”中,要用到的玻璃仪器除玻璃棒、烧杯外,还有_________。
(2)加入“适量稀HCl”的目的是_________。
(3)生成沉淀C的化学方程式为________。
(4)“操作3”的名称是_________。
(5)加入过量Na2CO3溶液的目的是________g。
(6)在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会_________(填“偏高”、“偏低”、或“无影响”)。
【答案】漏斗 除去溶液中过量的碳酸钠 CaCl2+Na2CO3=2NaCl+CaCO3↓ 蒸发 使氯化钙完全反应 偏高
【解析】
加过量碳酸钠溶液时为了出去氯化钙,操作2使固液分离,则操作2为过滤,应加入过量碳酸钠,所以加稀盐酸是为了除去过量的碳酸钠,操作3得到氯化钠固体,则该操作是蒸发结晶。
(1)由分析可知操作2为过滤,还需要用到的仪器有漏斗;
(2)加稀盐酸是为了除去过量的碳酸钠;
(3)沉淀C是碳酸钙,反应化学方程式为:CaCl2+Na2CO3=2NaCl+CaCO3↓;
(4)操作3是蒸发;
(5)加入过量Na2CO3溶液的目的是使氯化钙完全反应;
(6)量取液体俯视读数时水的实际体积偏小,则配得的溶液的溶质质量分数偏高。

【题目】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
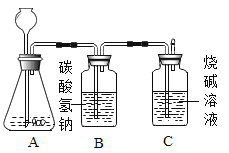
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x=______________。
(2)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线_______;
(3)计算大理石样品中碳酸钙的质量分数_______。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HC1气体,你认为对测量结果有没有影响_______?