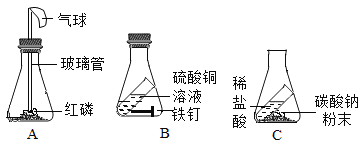
题目内容
【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量 10g 粉末状黄铜样品放入烧杯中, 把 60g 某浓度的稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如
下表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)m 的数值_____;
(2)10g 黄铜与 60g 稀硫酸充分反应后,生成氢气质量是_____。
(3)此黄铜样品中铜的质量分数是_____。
(4)该硫酸溶液的溶质质量分数是少?____。(写出计算过程,计算结果保留 1 位小数)
【答案】0.04 0.1g 67.5% 9.8%(过程见解析)
【解析】
锌和稀硫酸反应生成硫酸锌和氢气。
(1)第一次加入20g稀硫酸生成氢气0.04g,而第三次生成0.02g,则第二次也生成0.04g,故m的数值是0.04。
(2)由实验数据可知,第三次反应,锌和稀盐酸反应完全,故10g黄铜与60g 稀硫酸充分反应后,生成的氢气的质量为![]()
(3)设参加反应的锌的质量为x
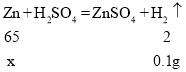
![]()
![]()
样品中铜的质量为![]()
故此黄铜样品中铜的质量分数是![]() 。
。
(4)设该硫酸溶液的溶质质量分数是y
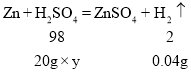
![]()
![]()
故该硫酸溶液的溶质质量分数为9.8%。

 全能闯关100分系列答案
全能闯关100分系列答案【题目】豆浆在欧美被誉为植物奶,豆浆机由于快捷方便而进入千家万户。请根据豆浆机结构的图示回答下列问题:
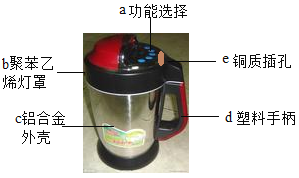
(1)制作材料中属于金属或合金的是______(选填一种物质编号)。铝是活泼金属,采用的铝合金外壳却有较强的抗腐蚀性,其原因是_______(用化学方程式表示)
(2)制作材料中属于有机合成材料的是___(选填一种物质编号);制作手柄的塑料属于______塑料(填“热塑性”或“热固性”);
(3)豆浆已成为众多家庭的早餐饮品,以下是豆浆中一些营养成分的平均质量分数。请根据下表回答:
成分 | 水 | 蛋白质 | 脂肪 | 糖类 | 钙 | 磷 | 铁 | 维生素A |
质量分数/% | 96.0 | 1.8 | 0.7 | 1.1 | 0.01 | 0.03 | 0.0005 | 0.015 |
①豆浆共能提供_____种营养素,豆浆中含有的微量元素是________;
②青少年缺乏_____元素易患有佝偻病,缺铁易患________病;
③在豆浆所含的营养素中_____是供给人体能量最主要的营养素。
④若成年人每天食用90g豆浆,则摄入蛋白质的质量为______g。