题目内容
【题目】化学小组探究镁、铁、铜三种金属的活动性顺序,设计了如图所示实验方案. 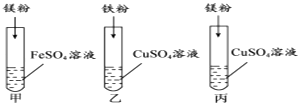
(1)试管乙中观察到的现象是 , 反应的化学方程式为 .
(2)同学们经讨论后认为该方案可以优化,试管的实验是多余的.
(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,若向滤渣中加入稀硫酸,有气泡产生,则滤渣的成分可能是 . 若向滤渣中加入稀硫酸,无气泡产生,则滤液的成分可能是 .
【答案】
(1)铁的表面有红色物质生成,溶液由蓝色逐渐变成浅绿色;Fe+CuSO4═FeSO4+Cu
(2)丙
(3)铁或铁和镁;硫酸镁、硫酸亚铁、硫酸铜或硫酸镁、硫酸亚铁
【解析】解:(1)试管乙中铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,现象是:铁的表面有红色物质生成,溶液由蓝色逐渐变成浅绿色;反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;(2)甲、乙就可以证明三种金属的活动性强弱是:Mg>Fe>Cu,故丙是多余的;(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,若向滤渣中加入稀硫酸,有气泡产生,说明了一定有置换出的铁,则滤渣的成分可能是铁或铁和镁.若向滤渣中加入稀硫酸,无气泡产生,说明了镁的量不足,没有置换出的铁,则滤液的成分可能是硫酸镁、硫酸亚铁、硫酸铜或硫酸镁、硫酸亚铁. 故答案为:(1)铁的表面有红色物质生成,溶液由蓝色逐渐变成浅绿色,Fe+CuSO4═FeSO4+Cu;(2)丙;(3)铁或铁和镁;硫酸镁、硫酸亚铁、硫酸铜或硫酸镁、硫酸亚铁.
(1)试管乙中铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,现象是溶液有蓝色变为浅绿色,生成红色固体;(2)甲、乙就可以证明三种金属的活动性强弱,故丙是多余的;(3)根据金属活动性顺序表的应用分析判断.

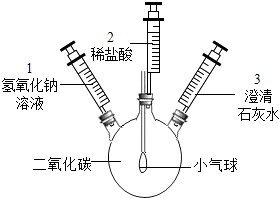
【题目】化学小组的同学探究二氧化碳与氢氧化钠的反应,实验方案如下:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
②… | 无明显现象 | |
③将注射器2中的溶液推入瓶中 | 溶液中有气泡产生,气球变瘪 | |
④向外拉注射器3 | 澄清石灰水变浑浊 |
(1)步骤①中气体鼓起的原因可能是 .
(2)步骤②中的操作是 , 其目的是 .
(3)步骤④中发生反应的化学方程式为 .
(4)本实验的结论是 .