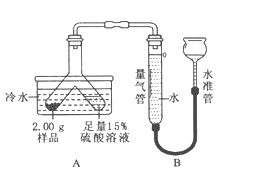
题目内容
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。某研究小组采用如下实验流程用Na2CO3溶液吸收SO2制备Na2SO3。
反应Ⅰ中随着SO2的增加,依次发生如下化学反应:
SO2+H2O+2Na2CO3=Na2SO3+2NaHCO3;
SO2+2NaHCO3=Na2SO3+2CO2↑+H2O;
SO2+H2O+Na2SO3=2NaHSO3

(1)H2SO3的名称为亚硫酸,则Na2SO3的名称为______。
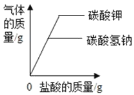
(2)分析反应1提供的资料,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如图1所示。则线1表示______(填化学式,下同)的质量分数的变化情况,线2表示______的质量分数的变化情况。
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应I中生成的NaHSO3转化为Na2SO3则该化学反应方程式为______。

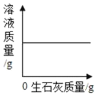
(4)常用蒸发结晶的方法分离混合溶液得到Na2SO3,由此可知,Na2SO3的溶解度曲线是与图2中的______(填A或B)物质的溶解度曲线相似。
(5)过滤操作得到的滤液中一定含有的溶质的化学式为______。
(6)实验后,将Na2SO3样品放置在烧杯中,一段时间后,检测发现样品中出现Na2SO4杂质,且放置时间越长产生的Na2SO4越多,则Na2SO3样品变质为Na2SO4的化学反应方程式为______。
【答案】亚硫酸钠 Na2CO3 Na2SO3 NaOH+NaHSO3=H2O+Na2SO3 B Na2SO3 O2+2Na2SO3=2Na2SO4
【解析】
(1)由于H2SO3的名称为亚硫酸,所以Na2SO3的是亚硫酸对应的钠盐,所以名称为亚硫酸钠;
(2)向碳酸钠溶液通入二氧化硫的过程中,碳酸钠应该越来越少,所以线1表示 Na2CO3的质量分数的变化情况,反应的前两步都有Na2SO3生成,最后一步Na2SO3完全消耗,线2表示 Na2SO3的质量分数的变化情况;
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应1中生成的NaHSO3转化为Na2SO3,是氢氧化钠和亚硫酸氢钠反应生成亚硫酸钠和水,对应的化学反应方程式为 NaOH+NaHSO3=H2O+Na2SO3;
(4)常用蒸发结晶的方法分离混合溶液得到Na2SO3,说明亚硫酸钠的溶解度随温度变化不大,所以Na2SO3的溶解度曲线是与题图2中的 B物质的溶解度曲线相似;
(5)过滤操作,所以得到的滤液是亚硫酸钠的饱和溶液,所以一定含有的溶质的化学式为 Na2SO3;
(6)实验后,将Na2SO3样品放置在烧杯中,一段时间后,检测发现样品中出现Na2SO4杂质,且放置时间越长,产生的Na2SO4越多,是亚硫酸钠和空气中的氧气反应生成硫酸铵,对应的化学反应方程式为 O2+2Na2SO3=2Na2SO4。

【题目】化学课上,老师在一瓶充满CO2软塑料瓶中加入适量NaOH溶液,振荡,发现软塑料瓶变瘪。针对这一有趣的现象,同学们发表自己的见解,请参与其中,并完成下列问题。
(1)小亮同学该现象说明了CO2和NaOH确实发生了反应。塑料瓶变瘪的原因是_____,二者反应的化学方程式为_____。小芳同学提出了质疑,她认为上述实验不足以证明CO2和NaOH确实发生了反应,其原因是_____。
(2)要证明一个反应是否发生,可以从以下两个角度思考。
①证实反应物减少。我思考后,设计了如图所示的甲、乙对照实验,该实验需要控制的变量有_____,实验现象是_____。

②证实有新物质生成。小霞同学为证明有碳酸钠生成,设计如下实验方案,我们帮她完成。
实验步骤和方法 | 实验现象 | 实验结论 | |
方案一 |
| _____ | CO2和NaOH确实发生了反应 |
方案二 | _____ | _____ |
写出方案二中所涉及的反应化学方程式_____。
(3)由此探究,我得到的启示是_____。(写出一点即可)