题目内容
【题目】下列四个图象分别与选项中的操作相对应,其中合理的是
A. 温度不变,向一定量的饱和石灰水中加入生石灰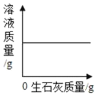
B. 向一定量盐酸中滴加氢氧化钠溶液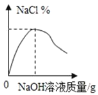
C. 向等质量的碳酸钾和碳酸氢钠中分别加入足量稀盐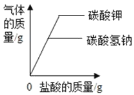
D. 向一定量的用硝酸酸化的硝酸银溶液中滴加稀盐酸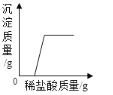
【答案】B
【解析】
A.氧化钙和水反应生成氢氧化钙,所以一定温度下,向一定量的饱和石灰水中加入生石灰,溶剂质量减小,溶质质量也相应的减小,溶液质量也会减小,不会保持不变,故错误;
B.氢氧化钠和盐酸反应生成氯化钠和水,所以随着氢氧化钠的加入,氯化钠的质量逐渐增大,氯化钠的质量分数也逐渐增大,氢氧化钠和盐酸恰好完全反应,氯化钠的质量分数达到最大值,然后继续氢氧化钠的加入,氯化钠的质量分数会逐渐减小,故正确;
C.向等质量的碳酸钾和碳酸氢钠中分别加入足量稀盐,碳酸钾的相对分子质量大,产生的二氧化碳的质量少,故错误;
D.氯离子和银离子一接触就会生成氯化银沉淀,所以沉淀质量应该从零开始,故错误。故选:B。

【题目】溶液与人们的生活息息相关。
(1)以下是有关CO2气体溶解度的几组数据:
CO2在水中的溶解度(单位:mL)
压强/大气压 | 温度/℃ | ||||
0 | 25 | 50 | 75 | 100 | |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
请根据数据
①根据CO2在水中的溶解度表,叙述外界条件是如何影响气体溶解度的?_____。
②打开可乐瓶有气体溢出,说明原瓶中的压强_____(填“大于”“小于”或“等于”)瓶外大气压强。
(2)以饱和NaCl溶液跟饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3=NaHCO3↓+NH4Cl,该反应中的四种物质的溶解度曲线如图所示。
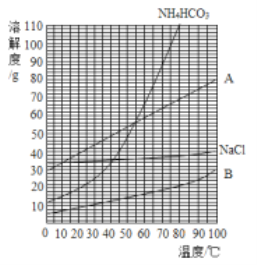
请回答下列问题。
①35℃时,比较A、B溶解度的大小:A_____B。
②图中表示碳酸氢钠溶解度曲线的是_____(填“A”或“B”)。
③发生上述反应析出晶体后的母液是碳酸氢钠的_____(填“饱和”或“不饱和”)溶液。写出母液中所有溶质的化学式_____。
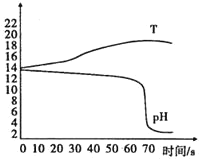
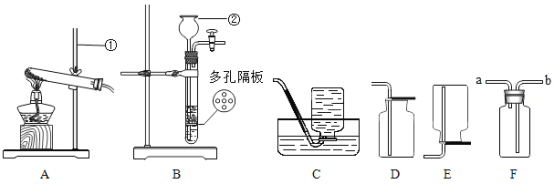
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
(假设猜想)针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4; 猜想二:有Na2SO4和H2SO4; 猜想三:有Na2SO4、H2SO4和NaOH
猜想四:____
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是_____,
理由是____.
(实验探究)
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有____.
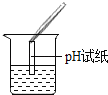
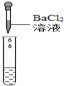
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究.
实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是_____;
②实验方案中也有一个是错误的,错误的原因是_____