题目内容
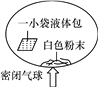
【题目】某固体粉末由Mg、MgO、Mg (OH)2中的一种或几种组成。某化学小组为了探究该固体粉末的成分,设计如图所示的装置(固定装置省略)。
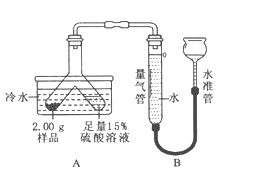
【信息资料】本实验条件下,氢气密度为0.09g/L。
【实验过程】
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测的生成气体的探究为55.6mL。
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生成沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
【回答问题】
(1)该套装置气密性的检验方法是 。
(2)①使样品与硫酸充分反应的正确操作是 (填标号)。
A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中
②判断样品完全反应的现象是 。
(3)根据实验结果分析:
①通过步骤Ⅱ推断,样品中一定含有的物质是 。
通过步骤Ⅲ计算,样品中镁元素的总质量为 。
②结论:该样品中的成分是 。
【反思】
(4)该化学小组同学经过讨论得出以下结论,正确的是 (填标号)。
A.利用该实验方案,能计算出样品中各物质的质量
B.实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应
C.仅称量步骤Ⅱ中Y形管内药品减轻的质量,即能计算出样品中各物质的质量
【答案】(1)把水准管下移一段距离,使水准管和量气管中的水形成一定的液面差,如果一段时间后液面差保持不变,则说明装置不漏气;反之,则表示装置漏气。 (2)①A ②Y形管中的固体全部消失 (3)①Mg 1.20 ②Mg、MgO和Mg(OH)2 (4)AB
【解析】
试题分析:【回答问题】(1)该套装置气密性的检验方法是把水准管下移一段距离,使水准管和量气管中的水形成一定的液面差,如果一段时间后液面差保持不变,则说明装置不漏气;反之,则表示装置漏气。(2)①使样品与硫酸充分反应的,因为硫酸过量,故将硫酸溶液转移到样品中答案选择A;②判断样品完全反应的现象是Y形管中的固体全部消失;(3)根据实验结果分析:①通过步骤Ⅱ推断,样品中一定含有的物质是金属镁,因为产生一定量的氢气;通过步骤Ⅲ计算,样品中镁元素的总质量为2.90g×24/58=1.2g;②设混合物中金属镁的质量为x
Mg + H2SO4 === MgSO4 + H2↑
24 2
X 55.6mL÷1000L/mL×0.09 g/L
24/2=X/(55.6mL÷1000L/mL×0.09 g/L0
X=0.6g
由其他物质提供的 金属镁得质量为:1.2g-0.6g=0.6g;镁元素的质量分数为:0.6g/(2g-0.6g)×100%=42%
该质量分数大于氢氧化镁中的镁的质量分数,小于氧化镁中的质量分数;得到结论:该样品中的成分是Mg、MgO和Mg(OH)2的混合物;(4)该化学小组同学经过讨论得出以下结论,正确的是A.利用该实验方案,能计算出样品中各物质的质量B.实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应。