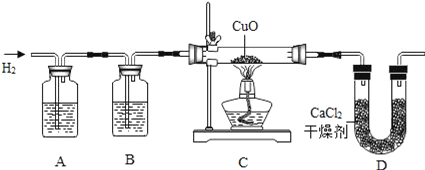
��Ŀ����
����Ŀ��ͼ1ΪNaCl��KNO3���ܽ�����ߡ�
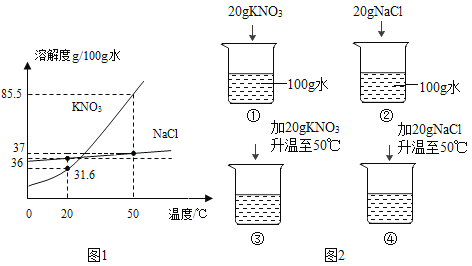
��1��20��ʱ��KNO3���ܽ����_______��
��2��50��ʱ����50gKNO3������뵽50gˮ�еõ�����KNO3��_______������͡������͡�����Һ����ʱ��Һ����������������_______��������0.1%��
��3����ȥNaCl��Һ�л���������KNO3���ᴿNaCl�ķ�����_______��
��4��20��ʱ��ijͬѧ������ͼ2ʵ�飬�õ���Ӧ��Һ��~�ܣ�˵����ȷ����______��
A�٢�����Һ�����������������
B�ۢ�����Һ�����������������
C���ۢܽ�����20�棬���о���������m(KNO3)��m(NaCl)
D���ۢܽ�����20�棬���ʵ������ۣ���
���𰸡�31.6g/100gˮ ���� 46.1% �����ᾧ AC
��������
��1�����ܽ������ͼ��֪20��ʱ��KNO3���ܽ����31.6g/100gˮ�����31.6g/100gˮ��
��2��50��ʱ��KNO3���ܽ����85.5g/100gˮ����50��ʱ100gˮ��������ܽ�85.5gKNO3����50gˮ��������ܽ�42.75g������50g����غ����γɱ�����Һ�����ʵ���������=![]() ��100%��46.1%��������ͣ�46.1%��
��100%��46.1%��������ͣ�46.1%��
��3������ص��ܽ�����¶�Ӱ��ϴ��Ȼ��Ƶ��ܽ�����¶�Ӱ���С���������������ᾧ�������з���õ�NaCl����������ᾧ��
��4��A����ͼ�п�֪20��ʱ�٢��м����20g���ʶ���ȫ�ܽ��ˣ��������ձ��е��ܼ�����100g�������������������ȣ���A��ȷ��
B��50��ʱNaCl���ܽ����37g/100gˮ�����Լ����40gNaCl��û��ȫ���ܽ⣬50��ʱKNO3���ܽ����85.5g/100gˮ�����Լ����40g KNO3ȫ���ܽ⣬�������ձ��е��ܼ�������ͬ�����Ԣۢ�����Һ������������������ȣ���B����
C��������20��ʱ���Ȼ��Ƶ��ܽ����36g/100gˮ������ص��ܽ����31.6g/100gˮ���ʢܻ�����4g���ۻ�����8.4g����m(KNO3)��m(NaCl)����C��ȷ��
D�����ۢܽ�����20��ʱ�����е�����������Ϊ36g�����е�����������Ϊ31.6g�������ʵ������ۣ��ܣ���D����
��ѡAC��

 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�����Ŀ�����������ǻ�ѧ�г�����һ��ҩƷ������dz�ư�ɫ������ĩ���ڿ���������ˮ�ֺͶ�����̼��������ˮ����ˮ���ܷ�����Ӧ�����������ƺ������⣬����ʽ��Na2O2+2H2O=2NaOH+H2O2�������������ֽܷ�ų�������
��1������ˮ���������ʵ�鷽���ǣ�___________________________�������ķ�Ӧ����ʽ�ǣ�__________________________��
��2��ijͬѧΪ��֤���������Ƽ���ˮ���������������ƣ������ɵ���Һ�еμ��˼�����ɫ��̪��Һ���۲쵽����������Һ�ȱ�����Ϊ��ɫ������Դ��������̽����
������⣺ʲô������Һ�ȱ������ɫ��
��������裺
����1����ͬѧ����������ɫ��̪��Һ���ʵ�����Һ��ɫ����
����2����ͬѧ�����������ɵĹ�������ʹ��Һ��ɫ����
ʵ������ۣ�
a����ͬѧ����IJ��룬���������ͬѧ�ķ��ԣ���Ϊ______________________________��
b��Ϊ����֤�Լ��IJ��룬��ͬѧ��������·�����ʵ����֤��
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ����ϡ����������Һ���Թ��У��μ�1��2�η�̪��Һ������___________�۲����� | ��Һ��ȻΪ��ɫ | ____________________ |
���۽������㻹�������ͬ�IJ����������������µĺ����ļ���ͷ����㽫��ý�����4�֣�
����3��_____________
����3��
ʵ�鲽�� | ʵ������ | ʵ����� |
_________________ | _______________ | ______________ |