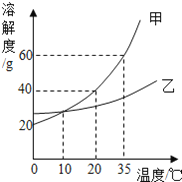
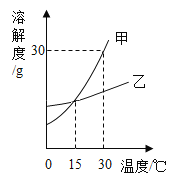
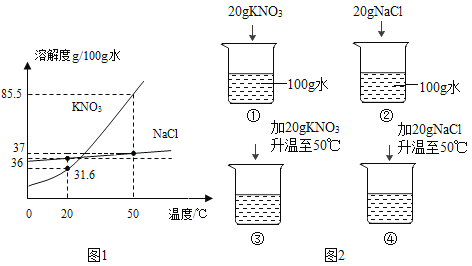
题目内容
【题目】酸与碱作用生成盐和水的反应叫做中和反应.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种,如图表示向甲中加入乙时溶液pH的变化曲线.请写出你从曲线图中所获取的信息:
(1)甲是_____;
(2)乙是_____;
(3)_____;
(4)_____.
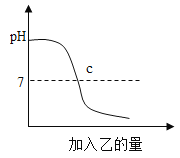
【答案】氢氧化钠溶液 盐酸溶液 c点表示两溶液恰好中和,c点的pH为7 两溶液恰好中和附近溶液pH变化快,反应前pH大于7,随着乙溶液的加入,溶液的pH逐渐减小
【解析】
图象中的pH值的起点在大于7 以上,说明原来的溶液显碱性,随着加入的乙的量的增加,pH值在逐渐的减小,与7相交的地方的pH值为7,根据曲线的陡缓程度可以确定反应的快慢,所以甲氢氧化钠溶液,乙是盐酸溶液,c点表示两溶液恰好中和,c点的pH为7.两溶液恰好中和附近溶液pH变化快,反应前pH大于7,随着乙溶液的加入,溶液的pH逐渐减小。

【题目】金属及合金是重要的工业及建筑材料。下表是A、B、C三种金属的部分物理性质。
性质 金属 | 导电性(100为标准) | 密度(g/cm3 ) | 熔点(℃) | 硬度(10为标准) |
A | 99 | 8.92 | 1083 | 3 |
B | 61 | 2.70 | 660 | 2.9 |
C | 17 | 7.86 | 1535 | 5 |
(1)三种金属中最不适宜作导线的是____________(填字母序号),高压输电线不用金属A而选用金属B,主要原因是__________________。
(2)C的合金通常可以做菜刀、锤子等,其合金的硬度_______________5(填“>”“<”或“=”)。
(3)钛(Ti)和钛合金被认为是21世纪重要的金属材料。以金红石(主要材料是TiO2)为原料生产钛的步骤有:①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到TiCl4和一种可燃性气体。②在稀有气体环境和加热条件下,用Mg和TiCl4反应得到Ti和MgCl2。其中步骤①中的化学方程式为_。