��Ŀ����
����Ŀ�����ô����������������ԭ���ȵ�����ͭ���ⶨˮ����ɡ�ʵ��װ����A��B��C��D��ɣ���������װ��ʡ��δ���������ش��������⣺
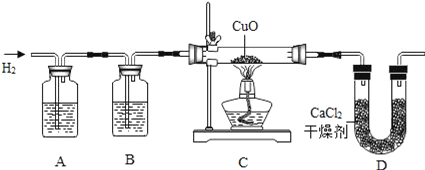
��1�����ijѧ����п�ͽ�Ũ��������ȡ����������װ��A��B��Ϊ�˵õ��������������������װ��A��ͨ����_____��Һ����������_____����װ��B��ͨ����_____��Һ����������_____��
��2����ʵ��ǰ����������£�װ����ͭ�IJ����ܵ���������6.4�ˣ�װ�Ȼ��Ƶ�U�ܵ�����������7.2�ˡ���������ʵ�����ݣ�д��ˮ���⡢������Ԫ�ص�����_____��
��3����װ��D�У���CaCl2�Ļ�Ϊ��ˮ����ͭ������Ϊ_____��
���𰸡�NaOH����AgNO3�� ����HCl���� Ũ���� �������� ��7.2g��6.4g����6.4g ��ɫ����ˮ����ͭ����ɫ
��������
��1������������ԭ����ͭ����ˮ��ͭ������ͼʾ��������������п�ͽ�Ũ�����ᷴӦ�Ƶã��������к����Ȼ��������ˮ��������Ҫ��ȥ���ǣ���װ��A��ͨ��������������Һ���������������Ȼ������巴Ӧ�����Ȼ�����Һ���������������Ȼ������壻��װ��B��ͨ����Ũ������Һ��������ˮ�ԣ�������������������ǣ�����������
��2��U�ιܼ����������C���Թܼ���������������ɵ�ˮ����Ԫ�ص�������D���ؼ����ɵ�ˮ��������ˮ���⡢������Ԫ�ص�������7.2g��6.4g����6.4g =1:8��
��3��ˮ��ʹ��ɫ����ˮ����ͭ����ɫ����������ˮ����ͭ����ˮ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���������Ͻ�����Ҫ�Ĺ�ҵ���������ϡ��±���A��B��C���ֽ����IJ����������ʡ�
���� ���� | �����ԣ�100Ϊ���� | �ܶȣ�g/cm3 �� | �۵㣨�棩 | Ӳ�ȣ�10Ϊ���� |
A | 99 | 8.92 | 1083 | 3 |
B | 61 | 2.70 | 660 | 2.9 |
C | 17 | 7.86 | 1535 | 5 |
��1�����ֽ���������������ߵ���____________������ĸ��ţ�����ѹ����߲��ý���A��ѡ�ý���B����Ҫԭ����__________________��
��2��C�ĺϽ�ͨ���������˵������ӵȣ���Ͻ��Ӳ��_______________5����������������������������
��3���ѣ�Ti�����ѺϽ���Ϊ��21������Ҫ�Ľ������ϡ��Խ��ʯ����Ҫ������TiO2��Ϊԭ�������ѵIJ����У����ڸ����£�����ʯ�뽹̿�Ļ������ͨ��������Cl2�����õ�TiCl4��һ�ֿ�ȼ�����塣����ϡ�����廷���ͼ��������£���Mg��TiCl4��Ӧ�õ�Ti��MgCl2�����в������еĻ�ѧ����ʽΪ_��