题目内容
【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;
②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是_____(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH═1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想 1:只含 NaCl;
猜想 2:_____;
猜想 3:NaCl、NaHCO3
(设计实验)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 取一定量反应后的溶液于试管中,滴加_____ | 无明显现象 | 猜想 3错误 |
实验二 | 另取一定量反应后的溶液于试管中,______ | ______ | 猜想 2正确 |
实验二中涉及反应的化学方程式为______。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生 CO2的速率快慢和中和酸的能力强弱。
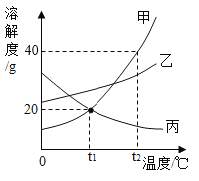
如图 1,利用数字化实验分别测定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生 CO2的速率快慢和 pH的变化,得到“二氧化碳浓度与时间”曲线(如图 2)、“pH与时间”曲线(如图 3)。
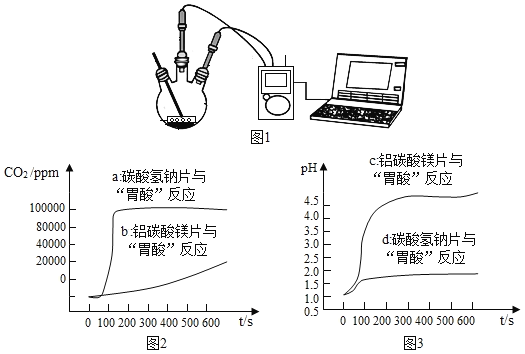
(1)服用碳酸氢钠片更易造成胃胀气,原因是_____。
(2)铝碳酸镁片中和酸的能力更强,理由是_____。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。
【答案】OH-、CO32- NaCl、HCl 稀盐酸 碳酸钠 有气泡生成 2HCl+Na2CO3 =NaCl+H2O+CO2↑ 相同时间下,碳酸氢钠片产生二氧化碳多 相同时间下,加入铝碳酸镁片后pH增大程度大
【解析】
活动一:
(1)根据抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性胃酸,氢离子为阳离子,与阴离子反应,铝碳酸镁片中阴离子有氢氧根和碳酸根,氢离子与氢氧根反应生成水,碳酸根与氢离子反应生成水和二氧化碳,都可以消耗氢离子,故答案为:OH-、CO32-。
(2)[作出猜想]
盐酸与碳酸氢钠反应生成氯化钠、水和二氧化碳,若恰好反应,则只有氯化钠,若盐酸过量,则为氯化钠和盐酸,若碳酸氢钠过量,则为氯化钠和碳酸氢钠,故答案为:NaCl、HCl。
[设计实验]
实验一中猜想3错误,说明不含有碳酸氢钠,加入稀盐酸后,不发生反应,无气体生成,没有明显现象;
实验二中猜想2正确,说明含有盐酸,而盐酸可与碳酸钠反应生成二氧化碳,所以可以看到有气泡;盐酸与碳酸钠反应生成氯化钠,水和二氧化碳,反应方程式为:2HCl+Na2CO3 =NaCl+H2O+CO2↑。
活动二:(1)在图2中,可以看出相同时间下,碳酸氢钠片与酸反应后,生成的二氧化碳较多,造成体内气体增多产生胀气;
(3)根据图3,可以看出相同时间下,加入铝碳酸镁片的酸中pH增加的多,说明酸性减小的多,因此中和的酸多;