题目内容
【题目】图中A~J是初中化学常见的物质,且分别由H、C、O、Na、S、Ca、Fe、Cu 中一种或几种元素组成。A、B、E、F属于氧化物;F、I中含有一种相同的元素;D可用 来改良酸性土壤;F和H的相对分子质量均为160; B、G分别与足量C反应的生成物相同。图中“一”表示两端的物质间能发生化学反应;“―”表示物 质间存在转化关系;部分反应物、生成物略去。
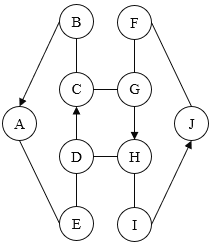
(1)写出化学式:B_________, J__________
(2)写出D→C反应的化学方程式:____________________________
(3)写出F与G反应的化学方程式:________________________________
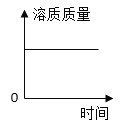
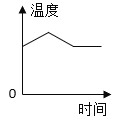
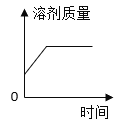
【答案】SO3 H2 ![]()
![]()
【解析】
在做推断题时,一定要充分把握题目条件。比如该题第一行中,元素种类H、C、O、Na、S、Ca、Fe、Cu,以及某些物质的类别、含有元素等均是非常重要的提示。
题眼——D可改良酸性土壤,则D为Ca(OH)2,F和H相对分子质量均为160,且F属于氧化物, 结合元素种类可知,F为Fe2O3,H为CuSO4。而“B、G分别与足量C反应的生成物相同”,暂时并不明确。剩余物质推断-----G可与Fe2O3反应,为还原性物质或酸,又因为G能生成CuSO4,可得 G—定为H2SO4。B为氧化物,且B、H2SO4分别与足量C反应的生成物相同,能够联想到 B为SO3,C为可溶性的碱,结合元素种类,只能为NaOH。A为氧化物,且可由SO3生成, 而目前我们学过SO3参与的反应,均为它与可溶性碱的反应,生成对应的硫酸盐和H2O,故A必为H2O。E能够与H2O反应,且能与Ca(OH)2反应,只能为CO2。I与Fe2O3含有一种相同的元素,该元素仅能为铁元素或氧元素,且I能与CuSO4反应,故 I必为Fe。最后,J可与Fe2O3反应,为还原性物质或酸,且其能被Fe生成,必为H2。
(1)由分析可知,B为三氧化硫,化学式为:SO3;
J为氢气,化学式为:H2;
(2)D→C为氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:![]() ;
;
(3)F与G反应为氧化铁与硫酸反应生成硫酸铁和水,该反应的化学方程式为:![]() 。
。

【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 10 | m |
第2次 | 10 | 7.4 |
第3次 | 10 | 6.1 |
第4次 | 10 | 5.6 |
第5次 | 10 | n |
试回答下列问题:
(1)从以上数据可知,最后剩余的5.6g固体的成分是_____;表格中,m=_____,n=_____。
(2)黄铜样品中锌的质量分数为_____。
(3)计算所用稀硫酸中硫酸的质量分数为_____。
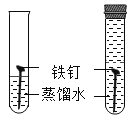
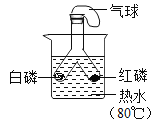
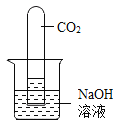
【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;
②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是_____(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH═1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想 1:只含 NaCl;
猜想 2:_____;
猜想 3:NaCl、NaHCO3
(设计实验)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 取一定量反应后的溶液于试管中,滴加_____ | 无明显现象 | 猜想 3错误 |
实验二 | 另取一定量反应后的溶液于试管中,______ | ______ | 猜想 2正确 |
实验二中涉及反应的化学方程式为______。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生 CO2的速率快慢和中和酸的能力强弱。
如图 1,利用数字化实验分别测定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生 CO2的速率快慢和 pH的变化,得到“二氧化碳浓度与时间”曲线(如图 2)、“pH与时间”曲线(如图 3)。
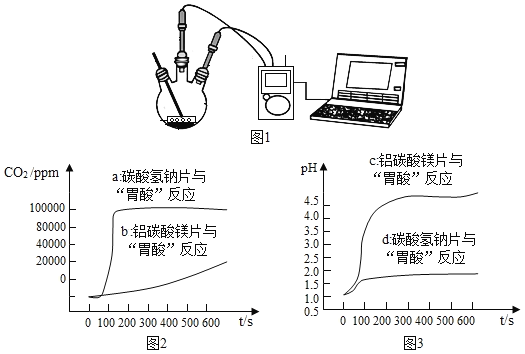
(1)服用碳酸氢钠片更易造成胃胀气,原因是_____。
(2)铝碳酸镁片中和酸的能力更强,理由是_____。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。