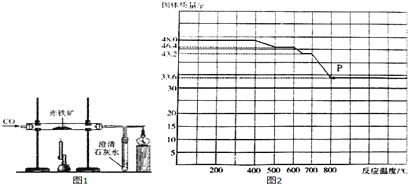
题目内容
【题目】等质量的A、B、C三种金属分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如下图所示。下列说法中正确的是(已知A、B、C在生成物中均为+2价)( )

A. 反应后溶液的质量:A >B >C B. 消耗金属的质量:A >B >C
C. 消耗盐酸的质量:A >B >C D. 相对原子质量:A >B >C
【答案】C
【解析】A、由图可知等质量的A、B、C三种金属分别和足量的同体积、同浓度的盐酸反应,A产生的气体的质量最多,即溶液增加的质量最少,C产生的气体的质量最少,那么溶液增加的质量最多,故反应后溶液的质量:A <B <C,错误;B、由于加入的盐酸是足量的,故三种金属均完全反应,那么消耗金属的质量:A =B =C,错误;C、利用化学方程式,根据反应的质量比可知等质量的金属,相对原子质量越大的消耗的稀盐酸越少,产生的氢气的质量也越少,故消耗盐酸的质量:A >B >C,正确;D、相对原子质量越大的金属产生的氢气的质量也越少,故相对原子质量:A <B <C,错误。故选C。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目