题目内容
【题目】化学兴趣小组的同学进行了以下实验:向烧杯中加入变质的氢氧化钙固体和一定量的稀盐酸,一段时间后固体全部溶解。他们对所得溶液中的溶质成分进行了探究。
(1)Ⅰ.探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:;猜想二:CaCl2和HCl;
猜想三: CaCl2、Ca(OH)2;猜想四: CaCl2、Ca(OH)2和HCl;
根据所学知识判断,一定不成立。
(2)【查阅资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性。
【进行实验】
实验步骤:取少量烧杯内溶液加入试管中,滴入几滴酚酞溶液,振荡。
实验现象1:。结论:猜想三不成立。
实验步骤:取少量烧杯内溶液加入另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象2:。结论:猜想一不成立,猜想二成立。
(3)【反思与拓展】
酸性较强的液体直接进入下水道,会污染环境。要处理上述烧杯内的溶液,使其溶质只含有CaCl2 , 应向烧杯中加入过量的。
A.CaO
B.CaCO3
C.Ca(OH)2
(4)氢氧化钠在空气中变质的化学方程式。
(5)Ⅱ.取50g含CaCl2和HCl的混合溶液,向其中逐滴滴入溶质质量分数为5.3%的碳酸钠溶液,同时充分搅拌。测得生成的气体和沉淀的质量与加入的碳酸钠溶液的质量关系如下图所示。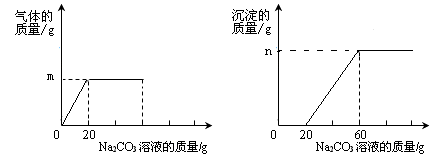
①由图可知,当碳酸钠溶液质量加到 g时,溶液中盐酸恰好反应完。
②原烧杯溶液中氯化钙的质量分数。(请写出计算过程)
【答案】
(1)CaCl2 ,猜想四
(2)不变红色,先产生气泡后生成沉淀
(3)B
(4)CO2+2NaOH=Na2CO3+H2O
(5)20,4.44%
【解析】氢氧化钙固体和稀盐酸生成氯化钙和水,所以反应后溶液中一定有氯化钙,还可能由过量的反应物,刚好完全反应时,只有溶质氯化钙;氢氧化钙溶液显碱性,能使酚酞试液变红,所以:取少量烧杯内溶液加入试管中,滴入几滴酚酞溶液,振荡,溶液不变色,可说明,反应后的溶液中无氢氧化钙。由于碳酸钙能与盐酸反应,所以,向CaCl2和HCl的混合溶液中滴加碳酸钠时,先和盐酸反应,因生成二氧化碳而冒气泡,盐酸反应完,再与氯化钙反应生产碳酸钙白色沉淀;将CaCl2和HCl中的氯化氢除掉,溶质只有氯化钙的方法可以向烧杯中加入过量的碳酸钙,因为碳酸钙和盐酸反应生成氯化钙、二氧化碳、水,不引入杂质;氢氧化钠在空气中变质,是氢氧化钠和二氧化碳生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O ;①由图可知,当碳酸钠溶液质量加到20g时,溶液中盐酸恰好反应完。②由图可知,和氯化钙反应的碳酸钠溶液为60g-20g=40g,设原烧杯溶液中氯化钙的质量为x则
CaCl2 + | Na2CO3=CaCO3↓+2NaCl, |
111 | 106 |
x | 40g×5.3% |
![]()
x=2.22g
原烧杯溶液中氯化钙的质量分数=2.22g÷50g×100%= 4.44%
答:略
【考点精析】关于本题考查的书写化学方程式、文字表达式、电离方程式和根据化学反应方程式的计算,需要了解注意:a、配平 b、条件 c、箭号;各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案