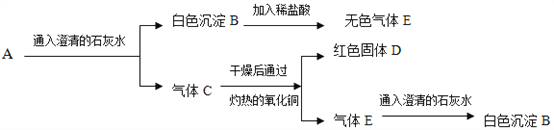
题目内容
【题目】钢铁是重要的金属材料。
Ⅰ、(1)硬铝、不锈钢是常见的金属材料。它们属于________(填“合金”或“纯金属”)。
(2)高层建筑的避雷装置,这主要是利用了金属材料的________(填序号)。
A.密度大 B.导电性 C.导热性 D.熔点高
Ⅱ、新型食品保鲜剂“纳米α铁粉”被称为“双吸剂”。
(1)“双吸剂”工作原理是利用了铁的生锈,铁生锈实质是铁与________和________等物质发生化学反应的结果,铁锈的主要成分是_________(填写化学式)。
(2)若用化学方法检验使用一段时间的“纳米α铁粉”是否完全失效,可选用___________检验,若出现______________的现象,说明该双吸剂仍可使用。
Ⅲ、工业炼铁的原理是,高温下焦炭在高炉中生成的一氧化碳跟铁矿石反应生成铁。请回答下列问题:
(1)写出以赤铁矿为原料在高温下炼铁的化学方程式:_______________________;
(2)加入焦炭,其作用除了燃烧产生热量外,还能____________(用化学反应方程式表示);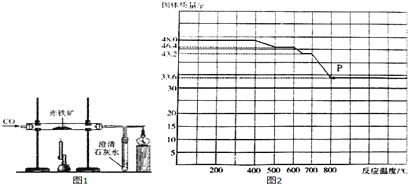
Ⅳ、善于提出问题、探究问题和解决问题是学好化学的重要方法,某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究。
(一).提出问题
问题1:铁为何称为黑色金属?
问题2:铁和氧气在不同条件下能发生哪些反应?
问题3:铁有多种氧化物,它们的性质有哪些差异?
问题4:钢铁厂在选矿时,如何测定铁矿石中的含铁量?
问题5:用一氧化碳还原氧化铁得到的黑色固体一定是单质铁吗?
(二).解决问题
【问题1】上网查寻,有两种说法:
a.因为在铁表面有黑色的铁的氧化物,所以叫黑色金属。
b.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属。
(1)你认为正确的说法是________(填“a”或“b”)。
【问题2】通过学习,已经知道铁丝在潮湿的空气中能生锈,也能在纯氧中燃烧。
(2)请写出一种防止钢铁生锈的方法_________;
(3)请写出铁丝在纯氧中燃烧的化学方程式_______。
【问题3】查阅资料:
a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,可以近似地看怍是氧化亚铁和氧化铁的化合物。它不溶于水,能与盐酸反应生成氯化亚铁、氯化铁和水。
c.氧化亚铁是不溶于水的黑色粉末,能与酸反应,无磁性,也不能被磁铁吸引。
(4)请写出四氧化三铁与盐酸反应的化学方程式_________。
【问题4】同学们参观了某钢铁厂,了解到钢铁厂在选矿时测定铁矿石中含铁量的方法较多,小明结合所学知识,设计了如图1所示的实验装置测定某赤铁矿样品中Fe2O3的质量分数。他称取l0.0g赤铁矿,当赤铁矿中的Fe2O3全部还原为Fe时,剩余固体在CO的保护下冷却、称量,质量为7.6g(假设赤铁矿中的杂质均不与CO反应)。
(5)图1中酒精灯的作用是__________。
(6)实验停止加热前是否需要将导管从澄清石灰水中取出,请说明理由__________。
(7)该赤铁矿中Fe2O3的质量分数为__________(列出计算过程)。
【问题5】在钢铁厂的实验室。同学们采集了用某种热分析仪记录的CO与Fe2O3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线。如图2所示。
(8)根据图象分析,写出P点时固体成分的化学式_______。固体质量由48.0g变为46.4g的过程中发生反应的化学方程式为________。
【答案】 合金 B O2 H2O Fe2O3 稀盐酸 有气泡冒出,溶液变为浅绿色 Fe2O3+3CO![]() 2Fe+3CO2 CO2+C
2Fe+3CO2 CO2+C![]() 2CO 【答题空10】a 涂油,喷漆(答案合理就给分) 3Fe+2O2
2CO 【答题空10】a 涂油,喷漆(答案合理就给分) 3Fe+2O2![]() Fe3O4 Fe3O4+8HCl=FeCl2+2FeCl3+4H2O 处理尾气,防止污染 不需要,因为停止加热后还不停的通一氧化碳 80% Fe 3Fe2O3+CO
Fe3O4 Fe3O4+8HCl=FeCl2+2FeCl3+4H2O 处理尾气,防止污染 不需要,因为停止加热后还不停的通一氧化碳 80% Fe 3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】Ⅰ、(1)硬铝、不锈钢是常见的金属材料中的合金;(2)高层建筑的避雷装置,这主要是利用了金属材料的导电性;Ⅱ、(1)铁生锈实质是铁与氧气和水等物质发生化学反应的结果,铁锈的主要成分是氧化铁;(2)铁和稀盐酸反应生成氢气,溶液变成浅绿色,可利用此方法检验是否失效; Ⅲ、(1)赤铁矿为原料在高温下炼铁的化学方程式:Fe2O3+3CO 高温2Fe+3CO2;(2)焦炭使CO2转化为CO的反应的化学方程式:CO2+C高温2CO;Ⅳ、(1)由于氧化铁为红色,四氧化三铁为黑色,则b的说法不正确,a说法正确;(2)防止铁生锈就是使铁与水或氧气隔绝,可以采用涂油或刷漆的方法等;(3)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2点燃Fe3O4;(4)由于四氧化三铁可以近似地看怍是氧化亚铁和氧化铁的化合物,所以四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,该反应化学方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;(5) 由于CO有毒,不能直接排放,应该在排放尾气的导气管口放一盏燃着的酒精灯,将多余的CO气体通过燃烧除掉;(6) 实验停止加热前不需要将导管从澄清石灰水中取出,因为停止加热后还不停的通一氧化碳;(7) 设该赤铁矿中Fe2O3的质量为x,
Fe2O3+3CO 高温2Fe+3CO2,质量减少
160 112 160-112=48
x l0.0g-7.6g=2.4g
![]()
x=8g
该赤铁矿中Fe2O3的质量分数为: ![]() ×100%=80%;(8) 根据氧化性Fe2O3>Fe3O4>FeO可知,与CO发生反应时,Fe2O3优先反应,然后Fe3O4反应,最后FeO反应,根据图象曲线可知,加热到800℃时三种氧化物反应完全,此时固体为Fe;固体质量由48.0g变为46.4g时,对应温度为400-500℃,根据氧化性Fe2O3>Fe3O4>FeO可知,此时是Fe2O3与CO反应,与CO发生反应时,失去氧48g-46.4=1.6g,氧化铁中氧元素为48×
×100%=80%;(8) 根据氧化性Fe2O3>Fe3O4>FeO可知,与CO发生反应时,Fe2O3优先反应,然后Fe3O4反应,最后FeO反应,根据图象曲线可知,加热到800℃时三种氧化物反应完全,此时固体为Fe;固体质量由48.0g变为46.4g时,对应温度为400-500℃,根据氧化性Fe2O3>Fe3O4>FeO可知,此时是Fe2O3与CO反应,与CO发生反应时,失去氧48g-46.4=1.6g,氧化铁中氧元素为48×![]() =14.4g,铁元素质量=48-14.4g=33.6g,残余固体中氧元素质量=14.4g-1.6g=12.8g,铁氧原子个数比=
=14.4g,铁元素质量=48-14.4g=33.6g,残余固体中氧元素质量=14.4g-1.6g=12.8g,铁氧原子个数比=![]() :
: ![]() =3:4,所以此时还原产物为Fe3O4,对应方程式是:3Fe2O3 +CO
=3:4,所以此时还原产物为Fe3O4,对应方程式是:3Fe2O3 +CO![]() 2Fe3O4+CO2。
2Fe3O4+CO2。

 备战中考寒假系列答案
备战中考寒假系列答案