题目内容
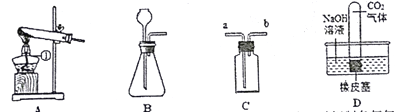
【题目】有一包白色粉末可能含硫酸钡、碳酸钠、和氢氧化钡中的一种或几种,取一定量的该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到有白色不溶物。
小张同学认为,白色粉末中一定含有硫酸钡;
小李同学认为,小张同学的结论不准确,其理由可用化学方程式表示为______________。
针对上述两名同学的观点,小刘同学进一步设计如下实验方案进行探究:

(1)步骤③中,滴入酚酞溶液后,若滤液E为红色,则滤液E中除酚酞外还一定含有的溶质是_______(填化学式,下同),由此得出原白色粉末成分组成的结论是______________。
(2)小王同学认为,只需要取少量滤渣B,加入过量的稀盐酸,若看到的现象是白色不溶物部分溶解,且有气泡产生,就足以说明原白色粉末的成分是__________________。
【答案】 Na2CO3 + Ba(OH)2 ==== BaCO3 ↓ + 2NaOH NaOH NaCl BaCl2 Na2CO3 Ba(OH)2 或BaSO4 Na2CO3 Ba(OH)2 BaSO4 Na2CO3 Ba(OH)2
【解析】Na2CO3 + Ba(OH)2 ==== BaCO3 ↓ + 2NaOH,碳酸钡是不溶于水的白色沉淀。(1)步骤③中加入酚酞溶液后为红色,说明溶液显碱性,Na2CO3 + Ba(OH)2 ==== BaCO3 ↓ + 2NaOH,根据步骤②加入过量的氯化钡溶液,BaCl2 + Na2CO3 == BaCO3↓+ 2NaCl,所以步骤③后的滤液中含有剩余的氯化钡,生成的氯化钠,以及显碱性的氢氧化钠。经以上分析可知,原白色粉末的组成可能是Na2CO3、Ba(OH)2或BaSO4、Na2CO3、Ba(OH)2。(2)硫酸钡沉淀不溶于稀盐酸,碳酸钡沉淀溶于稀盐酸,取少量滤渣B,加入过量的稀盐酸,白色不溶物部分溶解,且有气泡产生,说明滤渣中含有BaSO4,BaCO3,所以原白色粉末的成分是BaSO4、Na2CO3、Ba(OH)2。

【题目】从“丝绸之路”到“一带一路”的倡议促进了东西方经济、文化的交流和发展。
请从A、B两题中任选一个作答,并在答题纸上将所选的【A】或【B】用2B铅笔填涂为黑色。若两题均作答,计一道题分。
A | B |
“丝绸之路”把中国的丝绸茶叶传入西方,将西方的宝石传入中国。茶叶中含有维生素C,其化学式为C6H8O6,C6H8O6由______种元素组成。宝石的成分复杂,其中含有的Al2O3属于_____(填“单质”或“氧化物”), Al2O3中Al元素的化合价是_____。 | 能源合作是“一带一路”的重要内容,中缅油气管道将石油和天然气输入中国,石油属于____(选填“纯净物”或“混合物”)。天然气的主要成分是CH4 , CH4中碳、氢元素的质量比为_____,CH4完全燃烧生成CO2和____。 |