题目内容
【题目】下列所示的图象能反映相对应实验的是( )
A.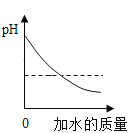 常温下向pH=10的NaOH溶液中不断加水稀释
常温下向pH=10的NaOH溶液中不断加水稀释
B.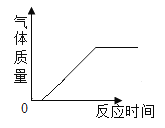 加热一定质量KMnO4粉末
加热一定质量KMnO4粉末
C.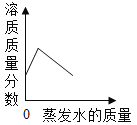 将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.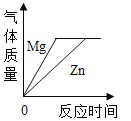 将等质量的金属镁片和锌片分别和足量的稀盐酸混合
将等质量的金属镁片和锌片分别和足量的稀盐酸混合
【答案】B
【解析】
A、氢氧化钠溶液显碱性,溶液pH值不可能小于7,所以选项A不符合题意;
B、刚开始加热高锰酸钾时未达到分解温度,不会产生气体,随着加热时间加长,温度升高,高锰酸钾受热分解,产生氧气,氧气质量开始增加,当高锰酸钾分解完毕后,不再有气体生成,质量不再变化,所以B符合题意;
C、![]() ,在温度不变的情况下,溶解度不变,所以溶液变为饱和溶液以后,溶质质量分数不再改变,所以选项C不符合题意;
,在温度不变的情况下,溶解度不变,所以溶液变为饱和溶液以后,溶质质量分数不再改变,所以选项C不符合题意;
D、设镁、锌和盐酸反应生成氢气的质量为m1、m2,
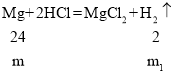
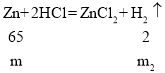
![]() ,
,![]()
![]() ,
,![]()
由此可以看出m1﹥m2,所以等质量的镁片与锌片制得氢气是镁制得质量大于锌制得氢气,选项D不符合题意。故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】瑞金市石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品9.0g于烧杯中,将50g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下。
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | 7.0 | 5.0 | 3.0 | 1.5 | x |
请计算:
(1)x的值为_____。
(2)完全反应后生产二氧化碳的质量为多少?(写出计算过程)______
【题目】“黄铜”是铜和锌的合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下。(烧杯质量均为56.5克)
1 | 甲 | 乙 | 丙 |
烧杯+稀盐酸质量 | 98.0g | 93.0g | 93.0g |
加入黄铜样品质量 | 10.0g | 12.0g | 10.0g |
充分反应后,烧杯+剩余物质质量 | 107.9g | 104.9g | 102.9g |
请回答下列问题:
(1)_____同学用的稀盐酸和黄铜样品恰好完全反应,他制取的氢气的质量是_____。
(2)计算黄铜样品中锌的质量分数_____(要求写出计算过程)。
(3)计算盐酸的质量分数为_____。