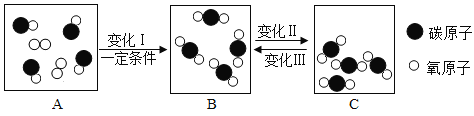
��Ŀ����
����Ŀ����ͳ�ƣ��ҹ�ÿ�걨�ϵ��ֻ�����1�ڲ�������������Ч�������ã�����ɾ���˷Ѻ���Ⱦ��ij���ֻ���·���к������½���: Sn��Pb�� Fe��Cu��Au��Ag��Ni ����������ɫ����Pd ���٣�����ɫ������ͼ��ij�����������в��ֽ���������ͼ���� ��������ͼ�и���Ӧ��ǡ����ȫ��Ӧ����֪:![]() ��
��

��1��������в������������;___________��дһ�֣�������2�к��еĽ�����_________��
��2������ݷ�Ӧ�Ļ�ѧ����ʽ_____________���÷�Ӧ����________________��
��3��������м�������Ƿ������ķ�����_____________��
��4������Fe��Ni��Pd����Һ�еĻ����ǿ������˳��������___________��
��5�����������Ҫ�õ��IJ���������____________��
���𰸡�����ȼ�� Sn��Pb��Ni Fe��CuSO4=FeSO4��Cu �û���Ӧ ����Һ2�м����������ۣ��۲��Ƿ��й������� Fe��Ni��Pd �ձ�����������©��
��������
�����̿�֪���������к�Sn��Pb�� Fe��Cu��Au��Ag��Ni��������ϡ���ᷴӦ��������������Һ������1û��Ni����Һ����ֻ�õ�FeSO4���壬˵��Ni�������ᷴӦ����Һ1��SnSO4��PbSO4��FeSO4��NiSO4����Һ1�����۷���Fe+ SnSO4=Sn+ FeSO4��Fe+ PbSO4=Pb+ FeSO4��Fe+ NiSO4=Ni+ FeSO4������2�к�Sn��Ni��Pb����Һ2�����������������ᾧ�õ�FeSO4���壻����1�м�ϡ���ᡢ��������![]() �����˷����Au��Ag��Pd����Һ3��CuSO4����Һ3��Fe����Fe+CuSO4=FeSO4+Cu����ɫ����AΪCu����Һ4����������������1��Cu��Au��Ag��Pd����
�����˷����Au��Ag��Pd����Һ3��CuSO4����Һ3��Fe����Fe+CuSO4=FeSO4+Cu����ɫ����AΪCu����Һ4����������������1��Cu��Au��Ag��Pd����
�������Ϸ�����֪��
��1������ڽ�������ϡ���ᷴӦ�����������������п�ȼ�ԣ���������ȼ�ϣ�����ۼ������������ۣ����Խ�Sn��Pb��Ni�û�����������2�к��еĽ����ǣ� Sn��Pb��Ni��
��2�����������ͭ������Ӧ����ͭ�����������Ļ�ѧ����ʽ��Fe��CuSO4=FeSO4��Cu
�÷�Ӧ���ϡ�����+������=п����+�»�����������û���Ӧ��
��3��������м�������Ƿ������ķ����ǣ�����Һ2�м����������ۣ��۲��Ƿ��й���������������������������������
��4������1��û������˵�������Խ��������û���˵�����Ľ�����Դ�������������ϡ���ᷴӦ���ٲ��ܷ�Ӧ��˵�����Ľ�����Դ����٣������Fe��Ni��Pd����Һ�еĻ����ǿ������˳�������ǣ�Fe��Ni��Pd��
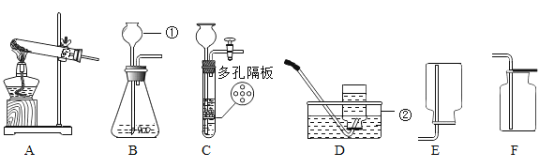
��5������ڷ���Һ����壬��Ҫ�õ��Ĺ���ʵ�����������в��������У��ձ������ڳн���Һ������������������������©�������ڹ��ˣ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��һ�������£������������ܱ������ڳ�ַ�Ӧ����÷�Ӧǰ������ʵ���������:
������ | ��ϩ��C2H4�� | ���� | ������̼ | ˮ | x |
��Ӧǰ������/g | 2.8 | 9 | 0 | 0 | 0 |
��Ӧ�������/g | 0 | 1 | 4.4 | 3.6 | ���� |
����˵����ȷ���ǣ� ��
A.��Ӧ��X������Ϊ2.6g
B.X��һ��������Ԫ��
C.�÷�Ӧ��������CO2��H2O�Ļ�ѧ������֮��Ϊ1: 1
D.X������Ԫ�ص�������Ϊ1:1