题目内容
【题目】(1)请按要求从 氢气、氧气、一氧化碳、盐酸、硫酸、氢氧化钠、熟石灰中选择合适的物质,将其化学式填写在下列横线上:
①具有可燃性的气体单质____
②具有挥发性的酸____
③具有还原性的气体氧化物____
④能做干燥剂的碱______
(2)荔枝素有“一日色变、二日香变、三日味变”的说法,目前最常用的荔枝保鲜剂,其主要成分是混有柠檬酸(C6H8O7)的冰盐水。柠檬酸能减少荔枝外壳表面的真菌,并让果皮处于微酸环境中,延缓其变色;冰盐水主要是利用低温抑制荔枝的呼吸强度,从而起到保鲜作用。
柠檬酸(C6H8O7)是一种重要的有机酸,又名枸橼酸,常温下是无色晶体,常含一分子结晶水,无臭,有很强的酸味,还有涩味,易溶于水,有微弱腐蚀性,潮解性。因为柠檬酸有温和爽快的酸味,且有较强的杀菌作用,普遍用于各种饮料、糖果、点心、罐头、乳制品等食品的制造。另外,柠檬酸属于果酸的一种,可以加快角质更新,也常用于各类美白、抗老化的化妆品中。采用柠檬酸或柠檬酸盐类作助洗剂,可改善洗涤产品的性能,增强洗涤效果。
根据上述信息,试回答:


①柠檬酸由__种元素组成,它属于___(选填“氧化物”、“无机物”、“有机物”之一)。
②每个柠檬酸分子共含有______个原子,其所含元素质量分数最大的是_______(填元素符号)。
③上述关于柠檬酸的描述中,属于物理性质的是(至少答一条)_______。
④下列关于柠檬酸的说法中,不正确的是___(填序号)。

A 荔枝保鲜剂的水溶液显酸性,因其含有较多氢离子
B 夏天可以用柠檬酸和小苏打、白糖自制碳酸饮料
C 柠檬酸是一种安全清洗剂,可快速去除水垢和异味
D 柠檬酸可用于去除铁锈,是利用了中和反应原理
【答案】H2 HCl CO NaOH 3 有机物 21 O 常温下是无色晶体,无臭,有很强的酸味,有涩味,易溶于水 等(至少答一条) D
【解析】
(1)①具有可燃性的气体是氢气,化学式为H2;②具有挥发性的酸是盐酸,盐酸是氯化氢溶于水形成的溶液,氯化氢的化学式为HCl;③具有还原性的气体氧化物为一氧化碳,化学式为CO;④氢氧化钠具有吸潮性的碱,可用于干燥,其化学式为NaOH;
(2)①根据柠檬酸的化学式C6H8O7可知,柠檬酸由C、H、O三种元素组成,符合有机物的定义;
②根据化学式可知一个柠檬酸分子由6+8+7=21个原子构成,其中质量分数最高的是O元素,质量分数为![]() ;
;
③物理性质是由物理现象得到的性质,题目中的“常温下是无色晶体,无臭,有很强的酸味,还有涩味,易溶于水”都是物理性质,至少选填一种即可;
④A、酸性溶液中含有较多氢离子,A正确;B、因柠檬酸溶液含较多氢离子,可以与小苏打生成二氧化碳,因此可制作碳酸饮料,B正确;C、柠檬酸为果酸,可食用,且酸性强,可除水垢和杀菌,杀菌后即可除异味,C正确;D、酸除铁锈是酸和金属氧化物的反应,中和反应是酸与碱的反应,故柠檬酸除铁锈不是利用中和反应原理,D错误;因此该空填D。

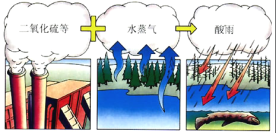
【题目】在学习了CO2的性质后,同学们了解到SO2与CO2的性质有一定程度的相似性,于是一中教育集团化学兴趣小组的同学们,对SO2的性质进行实验探究。
[实验探究I]SO2与活泼金属反应的探究.
[查阅资料]镁条在CO2中剧烈燃烧的化学方程式为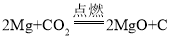 。
。
小开同学将点燃的镁条伸入装满SO2的集气瓶中,其实验现象为__________。
[实验探究II]SO2与NaOH溶液反应后生成的产物成分探究
[提出问题]SO2与NaOH溶液反应除生成水外,还可能有的生成物成分是什么?
[作出猜想]猜想1:亚硫酸钠(Na2SO3 )
猜想2:硫酸钠(Na2SO4);
猜想3:__________。
[查阅资料](1)Na2SO3能与酸反应产生SO2气体;
(2)SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸;
(3)Na2SO3有较强还原性,在空气中易被氧气氧化:![]() 。
。
[实验过程]甲、乙、丙三组同学分别进行实验探究:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 将一定量SO2气体通入NaOH溶液中, 取少量反应后溶液于试管中,滴加少量稀盐酸 | 不产生气泡 | 猜想1不成立 |
乙组 | 将一定量SO2气体通入NaOH溶液中,取少量反应后溶液于试管中,滴加足量氯化钡溶液 | 生成白色沉淀 | 猜想2成立 |
[实验评价](1)甲组方案是否严谨__(填“严谨”或“不严谨”),请说明理由:________。
(2)丙组认为乙组的方案不严谨,理由是_________________。
(3)丙组的方案是____________。
[实验结论]猜想1成立
[实验反思]乙组同学在实验室拿来一瓶久置的亚硫酸钠溶液,取少量溶液与稀盐酸反应,没有看到气泡生成,大家讨论后,一致认为保存亚硫酸钠时应_________。