��Ŀ����
ij��ѧ�С���ͬѧ��̽���������ᷴӦʱ������ͭ��Ũ�����ڼ����������ܹ�������Ӧ���������������塣��������⡿��������ijɷ���ʲô�أ�
���������ۡ����������ۣ������Ϊ���������������H2��SO2��SO3��O2�����壬����һ�������ȷ��û��SO3��O2�����Ǵ�Ҿ�����һ��̽������ɷ֡�
��������롿����٣������������ΪSO2������ڣ������������ΪH2������Ϊ����� ��
���������ϡ� SO2��һ���ж����壬����ȼ�գ���ʹ��ɫ��Ʒ����Һ��Ϊ��ɫ����һ����Ҫ������Ⱦ�H2����ʹ��ɫƷ����Һ��ɫ��ͭ��Ũ���ᷴӦʱ�������ܻᄏ�ࡣ
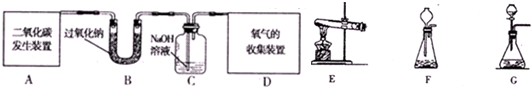
�����ʵ�顿��С���ͬѧ�ݴ���Ʋ��������ͼ��ʾ��ʵ�飺

����������ۡ�
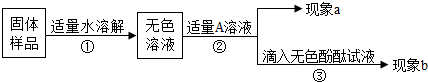
��1��ͼ��XΪ ��Һ��
��2��������ʵ���֪������ ����١��ڡ��ۣ���ȷ��
����˼�����ۡ�
��3������ý�����ϡ����ķ�Ӧ��ͬ��ͭ��Ũ���ᷴӦʱ����Ԫ�صĻ��ϼ� ��
��4��ʵ���������ͬѧ��Ϊ�ڴ���ͼ�з�Ӧ���Թ��в�Һʱ��Ӧ����ˮ����Һϡ�ͣ���ȷ�IJ��������� ��
(5)����ͬѧ��Ϊ���������Ӧͨ��һ��װ��NaOH��Һ���ձ��У���ԭ���� ��
����۲���������Ϊ��������������Ļ��������1��Ʒ�죻��2���٣���3�����ͣ�������ı䡱Ҳ���֣�����4������Һ�����ؼ���ˮ�У������Ͻ��裻��5�����ն���Ķ�������ֹ��Ⱦ����������:
��
��

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ