题目内容
【题目】现有一瓶混有少量氯化钾的硝酸钾粉末,请参照如图KCl和KNO3溶解度曲线,回答下列问题:

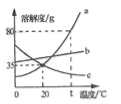
(1)t℃时,KCl和KNO3两种物质饱和溶液的溶质质量分数__________。
(2)t2℃时20g KCl溶于______g水中恰好形成饱和溶液。
(3)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的 是______的溶液。
(4)提纯混有少量氯化钾的硝酸钾的具体操作___________。
【答案】相等 50 KNO3 先将混合物溶于水中形成热的浓溶液,然后降温结晶,再进行过滤,即可分离得到较为纯净的硝酸钾晶体
【解析】
(1)t℃时,氯化钾和硝酸钾两种物质饱和溶液的溶解度相等,故溶质质量分数相等,故填:相等。
(2)t2℃时,氯化钾的溶解度为40g,故20g 氯化钾溶于50g水中恰好形成饱和溶液,故填:50。
(3)硝酸钾的溶解度随温度的升高变化明显,故t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的硝酸钾,故填:硝酸钾;
(4)在提纯混有少量氯化钾的硝酸钾时,需要采用降温结晶的方法,先在较高温度下将混合物溶于水中形成热的浓溶液,然后降低温度,即有大量硝酸钾晶体析出,再进行过滤操作,即可分离得到较为纯净的硝酸钾晶体,故填:降温结晶;过滤。

【题目】实验室里有一瓶标签破损的硫酸,为测定其实际的溶质质量分数,小明同学在烧杯中加入50g稀硫酸,然后向烧杯内滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的加入,溶液的pH变化情况如下表所示:
氢氧化钠溶液的质量/g | 溶液的pH | 溶液中的溶质 |
30 | pH<7 | a |
40 | pH=7 | b |
50 | pH>7 | c |
分析并计算:
(1)溶液中的溶质含有2种阴离子的是 ________(从abc中选)。
(2)计算硫酸溶液中溶质的质量分数________ (结果精确到0.1%)。