题目内容
【题目】工业上可利用黄铁矿(主要成分是Fe2S)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
① ②
②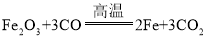 ③
③ ④
④![]()
下列说法不正确的是( )
A.反应①②③均有元素化合价发生变化
B.反应①②不属于四种基本反应类型中的任何一种,反应③④属于化合反应
C.将100g蒸馏水加入100g98%的浓硫酸中,可配制200g质量分数为49%的稀硫酸
D.将5gSO3溶于95g水形成溶液,其溶液中溶质的质量分数大于5%
【答案】C
【解析】
A、反应①中 ,FeS2中铁元素为+2价,硫元素为-1价,氧气中氧元素化合价为0,三氧化二铁中,铁元素为+3价,氧元素为-2价,二氧化硫中硫元素为+4价,氧元素为-2价,Fe、S、O元素化合价发生了改变;
,FeS2中铁元素为+2价,硫元素为-1价,氧气中氧元素化合价为0,三氧化二铁中,铁元素为+3价,氧元素为-2价,二氧化硫中硫元素为+4价,氧元素为-2价,Fe、S、O元素化合价发生了改变;
反应②中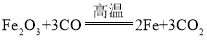 ,三氧化二铁中铁元素为+3价,氧元素为-2价,一氧化碳中氧元素为-2价,碳元素为+2价,铁中铁元素化合价为0,二氧化碳中氧元素化合价为-2价,碳元素化合价为+4价,Fe、C元素化合价发生了改变;
,三氧化二铁中铁元素为+3价,氧元素为-2价,一氧化碳中氧元素为-2价,碳元素为+2价,铁中铁元素化合价为0,二氧化碳中氧元素化合价为-2价,碳元素化合价为+4价,Fe、C元素化合价发生了改变;
反应③ ,二氧化硫中硫元素为+4价,氧元素为-2价,氧气中氧元素化合价为0,三氧化硫中氧元素为-2价,硫元素为+6价,S、O元素化合价发生了改变,不符合题意;
,二氧化硫中硫元素为+4价,氧元素为-2价,氧气中氧元素化合价为0,三氧化硫中氧元素为-2价,硫元素为+6价,S、O元素化合价发生了改变,不符合题意;
B、反应①②不符合四大基本反应类型的特点,不属于四种基本反应类型中的任何一种,反应③④符合“多变一”的特点,属于化合反应,不符合题意;
C、将100g蒸馏水加入100g98%的浓硫酸中,得到的硫酸溶液的溶质质量分数为:![]() ,但是稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌,使热量尽快的散发出去,一定不能将水注入浓硫酸中,符合题意;
,但是稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌,使热量尽快的散发出去,一定不能将水注入浓硫酸中,符合题意;
D、将5gSO3溶于95g水,三氧化硫能与水反应生成硫酸,![]() 形成的溶液为硫酸溶液,溶质质量大于5g,溶质质量分数大于5%,不符合题意。
形成的溶液为硫酸溶液,溶质质量大于5g,溶质质量分数大于5%,不符合题意。
故选C。

练习册系列答案
相关题目