题目内容
【题目】下列实验现象描述正确的是( )
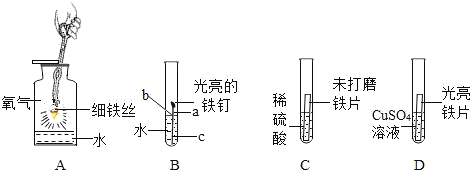
A. 氢氧化钠溶液有无色变为红色,最终又变为无色
B. 红棕色固体逐渐减少,溶液由无色变为黄色,放热
C. 最终正、负两极的玻璃管中所得的气体的质量比约为1:2
D. 黄色固体在氧气中燃烧,产生蓝紫色火焰,生成有刺激性气味气体
【答案】D
【解析】
A、氢氧化钠溶液不能变成红色,而是氢氧化钠溶液使酚酞试液变红色,该选项说法不正确;
B、氧化铁和稀盐酸反应生成氯化铁和水,氯化铁溶液是黄色溶液,但是不放热,该选项说法不正确;
C、电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2,质量比是8:1,该选项说法不正确;
D、硫在氧气中燃烧时,黄色固体在氧气中燃烧,产生蓝紫色火焰,生成有刺激性气味气体,该选项说法正确。
故选:D。

【题目】金属材料是人类社会发展的见证者,人类文明的发展和社会的进步同金属材料关系十分密切。
(一)生活中的金属
(1)没有镁的存在,就不能形成叶绿素,也就没有光合作用,这里的镁是指_____。
A 单质 B 元素 C 原子
(2)家用热水瓶内胆上的银白色金属是_____,传统血压计中的金属_____
(3)硬铝、不锈钢是常见的金属材料。它们属于_____(选填“合金”或“纯金属”)。
(4)为了减少和避免雷电对高层建筑的危害,需安装由金属材料制成的避雷装置,这主要是利用了金属材料的_____。(填序号)
A 密度大 B 导电性 C 导热性 D 熔点高
(二)一氧化碳还原氧化铁
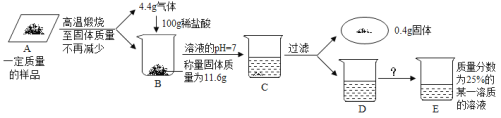
(实验探究)兴趣小组设计了如图所示实验装置进行实验。将24.0g某种铁的氧化物粉末放入玻璃管中,充分反应后,得到黑色固体粉末。反应前后称量相关装置和物质的总质量,其数据如下表:

反应前 | 充分反应后 | |
Ⅰ 组 | 玻璃管和红色粉末的总质量为44.0g | 玻璃管和固体物质的总质量为36.8g |
Ⅱ 组 | 试管和所盛溶液的总质量为30.0g | 洗气瓶和瓶中物质 的总质量为32.1g |
(交流讨论)
(1)实验时应先通CO气体,其作用是_____。
(2)该实验装置有一明显的不妥,你认为是_____。
(3)实验数据应该选择_____ 组的实验数据计算来确定黑色粉末的成分,不选择另一组的理由是_____(答一点即可)。最终计算结果表明:铁的氧化物粉末粉化学式是_____。
(三)成分分析
(查阅资料)用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO![]() 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO![]() Fe+CO2。
Fe+CO2。
改进上述实验装置,并用温控加热装置代替酒精灯探究CO与一定量的氧化铁反应。加热时固体质量随温度变化的曲线如图所示。回答下列问题:
(1)温度控制在300℃﹣﹣500℃范围时,固体质量没有发生变化,原因是_____。
(2)图中H点对应的固体成分是_____
(3)图中M点对应a的质量=_____。