题目内容
【题目】某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
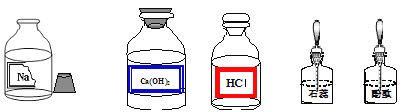
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液可能是:1、氯化钠溶液;2、氢氧化钠溶液;3、碳酸钠溶液。
【实验推断】(1)小丽取样滴加无色酚酞试液,溶液呈红色,得出结论:该溶液不可能是___________ 溶液,理由是__________________________;
(2)小刚另取样滴加稀盐酸有___________产生,反应的化学方程式为_________ ,小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确,理由 ___________________________。
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,可观察到有________产生,反应的化学方程式为 ___________________________ ,设计这一步骤的目的是_______________ ;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液里的溶质有_____________ 。
【探究启示】实验取完药品后应_______________。
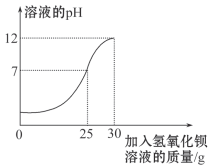
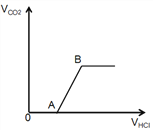
(4)【反思交流】小刚的实验过程中测得生成的二氧化碳气体与加入盐酸体积之间的关系如图所示:为什么刚开始没有气体冒出?(用化学方程式表示)_______________________。
A点时溶液中的溶质是___________________B点时溶液中的溶质是____________________。
【答案】 氯化钠 氯化钠溶液呈中性,不能使酚酞试液变色 气泡 Na2CO3 + 2HCl = 2NaCl+ H2O + CO2↑ 可能是露置于空气中的NaOH溶液与空气中的CO2反应生成碳酸钠 白色沉淀 CaCl2+Na2CO3= CaCO3↓+2NaCl 完全除去溶液中的CO32-,避免其对OH-检验造成干扰(或完全除去溶液中的碳酸钠)。 NaOH溶液(填变质的NaOH溶液也可) 【答题空10】立即盖好瓶盖 ![]() NaCl、Na2CO3 NaCl
NaCl、Na2CO3 NaCl
【解析】【实验推断】(1)氢氧化钠和碳酸钠溶液都呈碱性能使酚酞试液变红色,氯化钠溶液呈中性,所以,小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是氯化钠溶液;(2)若有碳酸钠存在,滴加盐酸,发生反应![]() ,有气泡产生。所以,小刚另取样滴加稀盐酸有气泡产生,小刚得出结论:该溶液是碳酸钠溶液;(3)因为该试剂是敞口放置于空气中,若是氢氧化钠可能会和空气中二氧化碳反应变质生成部分碳酸钠,所以,小青认为小刚的结论不完全正确,理由是露置于空气中的
,有气泡产生。所以,小刚另取样滴加稀盐酸有气泡产生,小刚得出结论:该溶液是碳酸钠溶液;(3)因为该试剂是敞口放置于空气中,若是氢氧化钠可能会和空气中二氧化碳反应变质生成部分碳酸钠,所以,小青认为小刚的结论不完全正确,理由是露置于空气中的![]() 溶液与空气中的
溶液与空气中的![]() 反应也生成碳酸钠。
反应也生成碳酸钠。
【继续探究】要证明原来是氢氧化钠,可先加过量氯化钡或氯化钙溶液溶液除尽碳酸根,再用酚酞检验氢氧化钠的存在。所以,另取样加入过量的![]() 溶液,可观察到有白色沉淀产生,其化学反应方程式为:
溶液,可观察到有白色沉淀产生,其化学反应方程式为: ![]() 设计这一步骤的目的是完全除去溶液中的
设计这一步骤的目的是完全除去溶液中的![]() ,避免其对
,避免其对![]() 检验造成干扰;静置后,取上层清液,滴入酚酞试液,溶液呈红色。【实验结论】这瓶溶液里的溶质有
检验造成干扰;静置后,取上层清液,滴入酚酞试液,溶液呈红色。【实验结论】这瓶溶液里的溶质有![]() 溶液,
溶液,
【探究启示】实验取完药品后应立即盖好瓶盖,防止![]() 溶液与空气中的二氧化碳反应而变质。(4)【反思交流】小刚的实验过程中刚开始没有气体冒出,是因为盐酸先与氢氧化钠反应,待氢氧化钠完全反应后,才开始与碳酸钠反应的缘故,一开始是发生的化学反应方程式为:
溶液与空气中的二氧化碳反应而变质。(4)【反思交流】小刚的实验过程中刚开始没有气体冒出,是因为盐酸先与氢氧化钠反应,待氢氧化钠完全反应后,才开始与碳酸钠反应的缘故,一开始是发生的化学反应方程式为: ![]() ;A点时盐酸与氢氧化钠恰好完全反应生成氯化钠和水,所以溶液中的溶质是
;A点时盐酸与氢氧化钠恰好完全反应生成氯化钠和水,所以溶液中的溶质是![]() 、
、![]() ;B点时盐酸和碳酸钠完全反应,故溶液中的溶质只有
;B点时盐酸和碳酸钠完全反应,故溶液中的溶质只有![]() 。
。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案