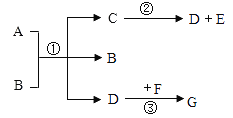
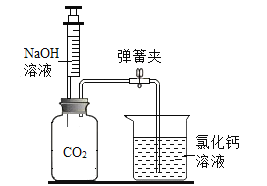
题目内容
【题目】某校化学兴趣小组对苏打Na2CO3和小苏打NaHCO3在生活中具有何作用、如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答相关问题。
(查阅资料)
信息①:相同条件下,碳酸钠溶液的碱性比碳酸氢钠溶液的碱性强;
信息②:NaHCO3在270℃完全分解,会产生一种白色固体以及二氧化碳和水,而Na2CO3不易分解。
(实验过程)
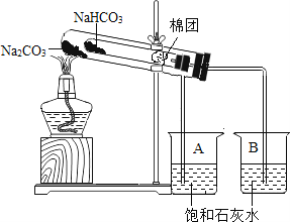
(1)棉花团的作用是_____。
(2)充分加热后,B烧杯中看到的现象是_____,写出碳酸氢钠分解的化学方程式_____。
(3)充分利用信息知识,区分无色Na2CO3溶液与NaHCO3溶液最简单的方法是_____(填字母)。
A 加热
B 用pH试纸测碱性强弱
C 滴加稀盐酸
(实验反思)
(4)将碳酸氢钠放在小试管中的原因是:如果颠倒顺序,碳酸氢钠在大试管中分解吸热,会导致小试管_____(填“受热充分”或“受热不充分”)。
(5)实验中应注意的问题是_____(任意写一条)。
【答案】防止药品粉末进入导管 石灰水变浑浊 ![]() B 受热不充分 加热时要预热
B 受热不充分 加热时要预热
【解析】
(1)棉花团的作用是防止药品粉末进入导管,干扰实验;
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以充分加热后,B烧杯中看到的现象是:石灰水变浑浊,碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:![]() ;
;
(3)相同条件下,碳酸钠溶液的碱性比碳酸氢钠溶液的碱性强,所以区分无色Na2CO3溶液与NaHCO3溶液最简单的方法是:用pH试纸测碱性强弱,故选:B;
(4)将碳酸氢钠放在小试管中的原因是:如果颠倒顺序,碳酸氢钠在大试管中分解吸热,会导致小试管受热不充分;
(5)加热固体的正确操作,需要先预热,然后对着药品部分集中加热,防止试管炸裂。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
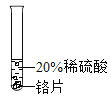
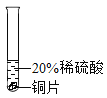
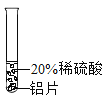
开心试卷期末冲刺100分系列答案【题目】小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的.他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动.
(预测)三种金属在金属活动性顺序中的相对位置关系:
①Cr>Al>Cu ②Al>Cr>Cu ③Al>Cu>Cr
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮.
实验方案 | 实验一
| 实验二
| 实验三
|
实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色. | ____ | 铝片表面产生气泡较快. |
结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | ____ |
结论 | 三种金属在金属活动性顺序中的相对位置关系是______(填序号) | ||
(回答问题)
(1)用砂纸打磨金属片的目的是______.
(2)实验一所发生反应的化学方程式是______(Cr与硫酸反应生成正2价的硫酸盐).
(3)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是______.
(4)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是______.
(5)(归纳)比较金属活动性强弱的方法有:①______,②______.
【题目】为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.5g二氧化锰混合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.34 | 2.04 | 2.04 |
请仔细分析实验数据,回答下列问题:
(1)在_____时间后,该样品中的氯酸钾已经完全反应
(2)完全反应后产生氧气的质量为_________;
(3)该样品中氯酸钾的质量分数为_________.