题目内容
【题目】根据图示回答相关问题。
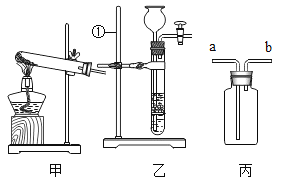
(1)标有“①”的仪器名称是______;
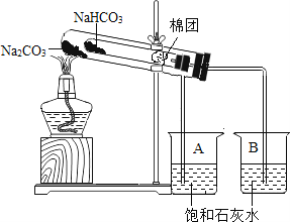
(2)实验室利用装置A制备少量二氧化碳,Y形管中盛放的固体物质是______(填名称,下同),液体物质是______。
(3)实验室利用装置B制备少量氧气实验时,酒精灯应加热Y形管内______(填“a”或“b”)处的固体。反应的化学方程式为______。
(4)选择仪器C-H完成以下实验操作:实验室用电石(固体,主要成分CaC2)和水反应制取乙炔(C2H2)气体,该反应极剧烈,为控制反应速率,发生装置应选仪器______(填序号),又因为乙炔气体的密度______(填“大于”或“小于”)空气的密度,故可采用 ______法收集。
(5)用电石制得的乙炔气体中常混有酸性气体,为了得到较纯净的C2H2,可将气体通过______溶液后,用排水法收集。
【答案】铁架台 大理石 稀盐酸 a 2KMnO4![]() K2MnO4+MnO2+O2↑ CEG 小于 向下排空气 氢氧化钠
K2MnO4+MnO2+O2↑ CEG 小于 向下排空气 氢氧化钠
【解析】
(1)仪器①是铁架台;
(2)实验室常用大理石(或石灰石)和稀盐酸反应制取二氧化碳,Y形管中盛放的固体物质是:大理石(或石灰石);液体是稀盐酸;
(3)因为管口有棉花,则Y型管内的固体是高锰酸钾,为了防止管口的冷凝水倒流使管底炸裂,酒精灯应加热Y形管内a处的固体;反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(4)验室用电石(固体,主要成分CaC2)和水反应制取乙炔(C2H2)气体,该反应极剧烈,不需要加热,为控制反应速率,发生装置应选仪器CEG;又因为乙炔气体的密度小于空气的密度,故可采用向下排空气法收集;
(5)因为酸性气体能和氢氧化钠溶液反应,为了得到较纯净的C2H2,可将气体通过氢氧化钠溶液后,用排水法收集。
故答案为:
(1)铁架台;
(2)大理石(或石灰石);稀盐酸;
(3)a;2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(4)CEG;小于;向下排空气;
(5)氢氧化钠。

 阅读快车系列答案
阅读快车系列答案【题目】某化学学习小组的同学对一瓶敞口放置氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
[提出问题]该瓶药品的化学成分是什么?
[查阅资料](1)氢氧化钙是一种白色粉末,俗称熟石灰或______,能与空气中的二氧化碳反应而变质。
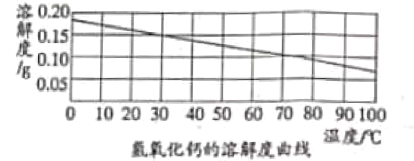
(2)氢氧化钙的溶解度曲线如图:
[猜想假设]
猜想一:Ca(OH)2;猜想二:CaCO3 ;猜想三:Ca(OH)2和CaCO3。
[实验验证]
实验操作 | 实验现象 | 实验结论 |
(1)取1g样品放入盛有50g水的烧杯中,充分搅拌后,静置 | 烧杯底部有较多固体未溶解 | 样品中含有CaCO3 |
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2-3滴无色酚酞溶液 | __________ | 样品中含有Ca(OH)2 |
[得出结论]甲同学认为猜想三正确。
[反思交流]
(1)乙同学认为甲同学的结论不合理,从上述氢氧化钙的溶解度曲线可知,因为___________,所以猜想一可能正确。
(2)丙同学认为要想验证猜想三正确,还需要做如下实验:取实验(1)中未溶解固体于试管中,向试管中加人足量的稀盐酸,如有____________,则猜想三正确。
(3)实验室的许多药品都需密封保存。例如氢氧化钠固休,氢氧化钠固体需要密封保存的原因是:①____________;②与空气中CO2反应而变质,氢氧化钠在空气中变质反应的化学方程式为_____________。
(4)同学们在试验Ca(OH)2溶液导电性实验时(如图),无意中观察到烧杯中的饱和石灰水变浑浊了,于是大家进行了热烈讨论。假如你也参与其中,请对此现象提出假设,并说明理由,然后设计实验进行验证。(只要求写出实验方案,不要写出现象及结论)
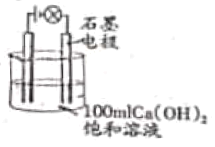
你的猜想:__________________。
理由:______________________。
实验方案:_____________________。
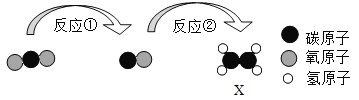
【题目】实验室常用下列装置来制取氧气:研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们的探究主要过程:
一、假设:过氧化氢生成氧气的快慢与催化剂的种类有关
二、实验方案:常温下,在两瓶相同体积的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各收集一瓶(相同体积)氧气所需要的时间。
三、进行试验:
(1)上图最左边是进行试验的装置图,气体发生装置中A仪器的名称是__________,检查装置气密性的方法是:_____________;此实验中B处最宜采用的气体收集方法是什么__________?请将图像补充完整_________。
(2)若用乙装置制取氧气,优点是_____________ 。若用甲装置来制取氧气时,则反应的文字表达式为____________ ,用丙装置收集所得到的氧气,气体应从_____________(填“a”或“b”)端导入。
四、实验记录
实验编号 | 1 | 2 |
反应物 | 6%H2O2 | 6%H2O2 |
催化剂 | 1g红砖粉 | 1gMnO2 |
时间 | 152s | 35s |
五、结论:该探究过程得出的结论是______________
六、反思:过氧化氢在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明MnO2和红砖粉是该反应的催化剂,还需要增加实验证明他们在化学反应前后_______和_______是否改变。
七、归纳:影响化学反应速率的因素可能还有那些?请你在猜测一种因素______。