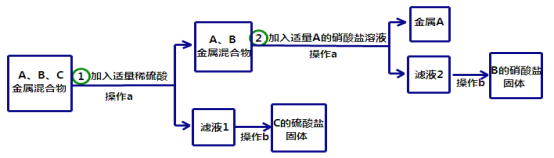
题目内容
【题目】(7分)中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
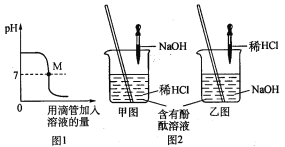
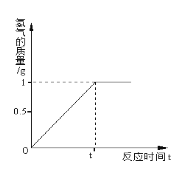
(1)上图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。
请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶
液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的_______(填甲或乙)图所示进行的。
②曲线上M点表示盐酸和氢氧化钠溶液反应的情况是_______。
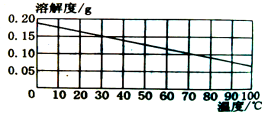
③向烧杯中倾倒20 g(滴有2滴酚酞试液)质量分数为4.0%的氢氧化钠溶液,振荡,再逐滴滴入质量分数为7.3%的稀盐酸,边滴边振荡,直至溶液刚好变为_______色为止,共用去稀盐酸10 g,则反应后溶液中溶质质量分数为_______。要使反应后的溶液变成20℃时的饱和溶液,需要加入氯化钠固体的质量是_______g(结果精确到0.1 g)。已知:20℃时氯化钠的溶解度为36.0 g。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:
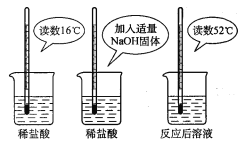
根据图示实验,甲同学认为:NaOH与稀盐 酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是__________。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5 g溶质质量分数分别为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40 g 20%的氢氧化钠溶液,最后测量其温度,数据记录如下:
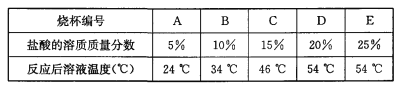
实验结论:影响该中和反应放出热量多少的因素是_______。
【答案】(1) ①乙 ②恰好完全反应 ③无 3.9% 9.2g
(2) 氢氧化钠固体溶于水也会放出大量的热 (3)盐酸的浓度越大,放出的热量越多
【解析】
试题分析:(1) ①根据图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化从大于7变为小于7,所以表示的是将稀盐酸加入到氢氧化钠溶液中,故选乙,②曲线上M点,此时的PH=7,说明盐酸和氢氧化钠溶液反应的情况是恰好完全反应,③根据化学反应:NaOH+HCl==NaCl+H2O中NaOH和NaCl的质量关系40:58.5,可求出溶质氯化钠的质量,可设质量为x,40:58.5=20g×4.0%:x,x=1.17g,所以反应后溶液中溶质质量分数=1.17g/30g×100%=3.9%,根据溶液的浓缩过程中,溶剂的质量不变,可设需要加入氯化钠固体的质量为y,可列式为:1.17g+y/30g+y=36/136,y=9.2g
(2) 为证明中和反应是放热反应,甲同学得出这个结论的依据不科学,理由是:氢氧化钠固体溶于水也会放出大量的热
(3) 根据表中的数据对比分析,影响该中和反应放出热量多少的因素是:在一定的浓度范围内。盐酸的浓度越大,放出的热量越多