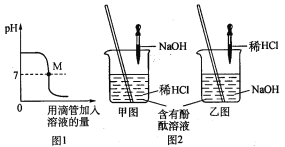
题目内容
【题目】(8分)请根据下列装置回答有关问题:

(1)写出图中标有①、②的仪器名称:①为 ;②为 。
(2)若用上述装置制取二氧化碳,则A中发生反应的化学方程式为 。要制取和收集一瓶干燥的二氧化碳气体,选用的装置有 (填字母代号),其装置接口的连接顺序是(用接口字母顺序从左至右连接) 。
(3)利用上述气体发生装置制取氧气,则A中发生反应的化学方程式为 。现要配制100g溶质质量分数为6%的双氧水溶液,需要30%的双氧水溶液 g,需要加入水的体积为 mL。
【答案】(1)锥形瓶 水槽 (2) CaCO3+2HCl==CaCl2+H2O+CO2↑ ABE acbg
(3) 2H2O2 MnO2 2H2O+ O2↑ 20 80
【解析】
试题分析:(1) 常见仪器的识记
(2) 气体的发生装置选择依据:反应物的状态和反应条件,故若用上述装置制取二氧化碳,说明是用大理石和稀盐酸反应,则A中发生反应的化学方程式为:CaCO3+2HCl==CaCl2+H2O+CO2↑,要制取和收集一瓶干燥的二氧化碳气体,则需要干燥,而气体的收集装置选择依据:气体的密度和溶解性,由于二氧化碳能溶于水且密度比空气大,所以只能用排水法收集,所以选用的装置有ABE,干燥的时候应采取长管进、短管出,所以其装置接口的连接顺序是acbg
(3) 上述气体发生装置是适合固体与液体在常温下反应,所以A中制取氧气发生反应的化学方程式为:2H2O2 MnO2 2H2O+ O2↑,溶液的稀释过程中,溶质的质量不变,所以可设需要30%的双氧水溶液的质量为x,可列式为:100g×6%=x×30%,x=20g,故需要加水的质量=100g-20g=80g,则加入水的体积为80 mL

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目