题目内容
【题目】熟石灰的溶解度曲线如图所示。现将30℃时的1g熟石灰加入100g水中充分搅拌、过滤,不计溶液损失,再将得到的溶液降温到20℃.下列判断正确的是
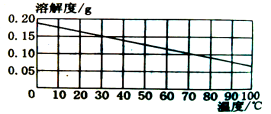
A.30℃时所得的溶液质量为101g
B.降温到20℃时溶质质量分数将变小
C.向熟石灰溶液中滴加紫色石蕊试液,熟石灰变蓝色
D.20℃时敞口静置一段时间后,则溶液表面会形成一层白膜。
【答案】D
【解析】
试题分析:A、从溶解度曲线,可看出30℃时熟石灰的溶解度为0.15g,所以将30℃时的1g熟石灰加入100g水中充分搅拌、过滤,所得的溶液质量为100.15g,错误, B、从溶解度曲线,可看出熟石灰的溶解度随温度的升高而降低,所以将30℃降温到20℃,溶解度增大,所以溶质质量分数将变大,错误,C、酸碱指示剂遇酸、碱而显示不同的颜色,向熟石灰溶液中滴加紫色石蕊试液,紫色石蕊试液变蓝色,而不是熟石灰变蓝色,错误,D、氢氧化钙会与空气中的二氧化碳反应,所以20℃时敞口静置一段时间后,则溶液表面会形成一层白膜,正确,故选D

练习册系列答案
相关题目