题目内容
化学小组取形状和大小均相同的镁片,锌片,铝片、铁片,分别与5%的稀硫酸反应,测得反应速度由大到小的顺序是:镁>锌>铁>铝。为什么实验结果与金属活动性顺序不完全一致呢?小组同学猜想可能的原因,设计了如下探究实验。(说明:实验中所用酸的体积相等且足量)
实验序号 | 操作 | 反应速度 | |
Ⅰ | 取形状和大小均匀相同的镁片、铝片、铁片、锌片,________。放入试管中,分别同时加入 | 5%的稀硫酸 | 镁>锌>铁>铝 |
Ⅱ | 10%的稀硫酸 | 镁>锌>铁>铝 | |
Ⅲ | 5%的稀盐酸 | 镁>铝>锌>铁 | |
Ⅳ | 10%的稀盐酸 | 镁>铝>锌>铁 |
(1)上述实验中横线处的操作是__________。设计实验Ⅰ、Ⅱ的目的是____________________。
(2)对比实验_____(填序号),初步判断铝与酸反应的速度在排序中出现变化的原因可能与_____有关,某同学向铝与不同浓度稀硫酸反应的试管中加入等量氯化钠固体,发现反应速度均明显变快,从微观角度分析,原因是_______________。
(3)实验后,同学们绘制了本次探究实验中铝与稀盐酸反应的下列图象,其中正确的是_____(填字母序号),判断依据为____________________。
A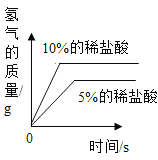 B
B 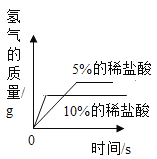 C
C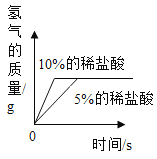
下列关于实验的操作、现象、结论描述都正确的是( )
实验操作 | 现象 | 结论 | |
A | 把碳在空气中点燃,再伸进充满氧气的集气瓶里 | 碳在空气中燃烧,产生红热现象;在氧气中剧烈燃烧发出白光 | 碳在空气中燃烧生成CO,在氧气中燃烧生成CO2 |
B | 在电解器的玻璃管中加满水,接通直流电源 | 正极收集气体的体积是负极的2倍 | 正极产生的是O2,负极产生的是H2 |
C | 高温条件下,将CO通入Fe2O3粉末 | 红色粉末变为黑色 | CO具有还原性 |
D | 用棉花分别蘸酒精和水,放到酒精灯火焰上加热 | 蘸酒精的棉花燃烧,蘸水的棉花不燃烧 | 燃烧的条件之一是需要氧气 |
A.A B.B C.C D.D