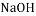题目内容
下列有关元素、原子、分子和离子的说法正确的是( )
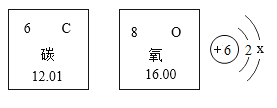
A.决定元素化学性质的是原子的最外层电子数
B.原子可以构成分子,不能直接构成物质
C.分子是化学变化中的最小微粒
D.离子一定比原子更稳定
碳酸锂是一种重要的锂盐,广泛应用于锂离子电池生产中。工业上可以用锂辉石精矿(主要成分是Li2O、含有Al2O3、SiO2等杂质) 为原料制取高纯的碳酸锂。某校化学活动小组收集了碳酸锂的溶解度数据如表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
设计了制取碳酸锂的工艺流程(如图):
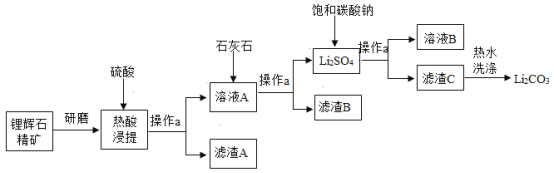
请回答:
(1)操作a所需的玻璃仪器有烧杯、玻璃棒和_____。
(2)热酸浸提中可能发生反应的化学方程式:
①_____;
②Li2O+H2SO4=Li2SO4+H2O。
(3)“洗涤”滤渣C时应该使用热水,其原因是_____。
(4)为了探究热酸浸提的最佳条件,将矿石在一定条件下酸浸4小时,测量锂元素浸出率的部分数据如表:
编号 | 矿酸比 | 硫酸浓度(%) | MgSO4用量(g) | 温度(℃) | 锂元素浸出率(%) |
1 | 1:1 | 90 | 0.00 | 100 | 70.34 |
2 | 1:1 | 98 | 0.00 | 100 | 73.89 |
3 | 1:1 | 98 | 0.00 | 150 | 78.24 |
4 | 1:3 | 98 | 0.00 | 200 | 85.53 |
5 | 1:3 | 98 | 1.25 | 250 | 90.26 |
6 | 1:3 | 98 | 2.50 | 250 | 95.88 |
①对比分析编号1和编号2的实验数据,可以得到的结论是_____。
②有同学想在实验6的基础上,从降低成本角度继续研究提高锂元素的浸出率,下面设计合理的是_____。
A 矿酸比1:2,硫酸浓度98%,MgSO4用量0.00,温度150℃
B 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度200℃
C 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度250℃
D 矿酸比1:3,硫酸浓度98%,MgSO4用量2.00,温度250℃
化学小组取形状和大小均相同的镁片,锌片,铝片、铁片,分别与5%的稀硫酸反应,测得反应速度由大到小的顺序是:镁>锌>铁>铝。为什么实验结果与金属活动性顺序不完全一致呢?小组同学猜想可能的原因,设计了如下探究实验。(说明:实验中所用酸的体积相等且足量)
实验序号 | 操作 | 反应速度 | |
Ⅰ | 取形状和大小均匀相同的镁片、铝片、铁片、锌片,________。放入试管中,分别同时加入 | 5%的稀硫酸 | 镁>锌>铁>铝 |
Ⅱ | 10%的稀硫酸 | 镁>锌>铁>铝 | |
Ⅲ | 5%的稀盐酸 | 镁>铝>锌>铁 | |
Ⅳ | 10%的稀盐酸 | 镁>铝>锌>铁 |
(1)上述实验中横线处的操作是__________。设计实验Ⅰ、Ⅱ的目的是____________________。
(2)对比实验_____(填序号),初步判断铝与酸反应的速度在排序中出现变化的原因可能与_____有关,某同学向铝与不同浓度稀硫酸反应的试管中加入等量氯化钠固体,发现反应速度均明显变快,从微观角度分析,原因是_______________。
(3)实验后,同学们绘制了本次探究实验中铝与稀盐酸反应的下列图象,其中正确的是_____(填字母序号),判断依据为____________________。
A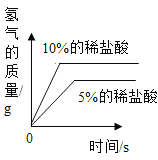 B
B 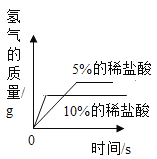 C
C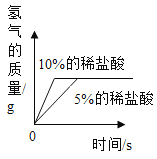
氯气(化学式为:Cl2)是一种黄绿色气体,其溶于水后得到的溶液称为氯水,氯气溶于水时,部分氯气会与水发生如下反应:Cl2+H2O=HCl+HClO,氯水显浅黄绿色, 氯水含有多种溶质,因而具有多种性质。已知:次氯酸(化学式为:HClO)具有强氧化 性,能够将有色物质(含酸碱指示剂)氧化为无色物质,但其酸性很弱,不能与含 CO3 的盐反应。请预测氯水的化学性质,说明预测的依据,并设计实验验证:限选试剂:Na2SO4 溶液、CaCO3 固体、AgNO3 溶液、紫色石蕊溶液、BaCl2 溶液、镁粉、铜片。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
① 能够与含Ag+的可溶性盐反应 | 氯水中含有Cl-,AgCl难溶于水。 | 取少量氯水于试管中,如果观察到,_______则预测成立 |
② 能够与_______(填物质类别)反应 | _____ | 如果观察到,_______则预测成立 |
③ 能够与_______(填物质类别)反应 | _____ | 如果观察到,_______则预测成立 |


 碱 制玻璃
碱 制玻璃
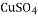 酸 制农药
酸 制农药