题目内容
某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠回体样品,进行如图所示的实验.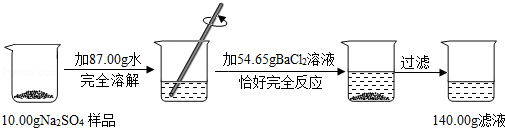
请跟据以上信息计算(结果保留到小数点后两位)
(1)反应生成沉淀的质量为 g.
(2)样品中硫酸钠的质量.
(3)求滤液中氯化钠的质量分数.
(1)11.65 (2)7.1g (3)6.25%
解析试题分析:(1)根据质量守恒定律,反应生成沉淀的质量为10g+87g+54.65g﹣140g=11.65g;
故答案为:11.65;
(2)解:设样品中硫酸钠的质量为x,反应中生成的氯化钠质量为y.
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233 117
x 11.65 g y
142:233=x:11.65g,解得x=7.1g
(3)233:117=11.65g:y,解得y=5.85g
滤液中氯化钠的质量=10.00g﹣7.1g+5.85g=8.75g
滤液中氯化钠的质量分数为: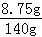 ×100%=6.25%.
×100%=6.25%.
答:(2)样品中硫酸钠的质量为7.1g;(3)滤液中氯化钠的质量分数为6.25%.
考点:根据化学反应方程式的计算.
点评:本题难度较大,主要考查了以化学方程式计算为基础,同时融入溶液等方面的计算题,这样的题目一直是中考的热点,主要培养学生的综合分析能力和计算能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
一般可以用向下排空气法收集的是
| A.CO2 | B.H2 | C.CO | D.O2 |
右图所示装置(不可倒置)有多种用途,下列叙述正确的是( )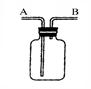
| A.若用排空气法收集CO2(密度比空气大)时,气体应从A端通入 |
| B.若用排空气法收集氧气时,气体从B端通入 |
| C.若用排空气法收集H2时,气体应从A端通入 |
| D.若用水将此装置中的O2排出,水应从B端进入 |