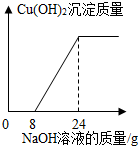
题目内容
10g含铜铁合金,投入盛有足量的稀硫酸的大烧杯中,充分反应后称的质量比反应前减少了0.2g,则原合金中铜的质量分数为多少?
设合金中铁的质量为x
Fe+H2SO4═FeSO4+H2↑
562
x 0.2g
=
解得:x=5.6g
原合金中铜的质量分数为:
×100%=44%
答:原合金中铜的质量分数为44%.
Fe+H2SO4═FeSO4+H2↑
562
x 0.2g
| 56 |
| x |
| 2 |
| 0.2g |
解得:x=5.6g
原合金中铜的质量分数为:
| 10g-5.6g |
| 10g |
答:原合金中铜的质量分数为44%.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目