题目内容
【题目】某实验小组的同学用氯化钙粉末、碳酸钠粉末、粒状大理石、稀盐酸、稀硫酸这几种药品,探究哪两种药品适合在实验室制取CO2。请你参与下列的探究并回答问题。
【资料卡片】硫酸钙微溶于水,易在碳酸钙表面形成一层隔膜。
【提出问题】上述的酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】小红认为可选用稀硫酸、氯化钙反应制得CO2,小江认为不可能,小江的理由是_____________。大家经过讨论后,设计了如下三个实验进行对比分析。
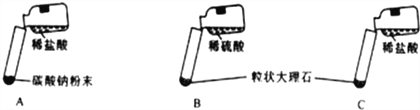
【实验与结论】(1)请你填写实验报告中①、②处的内容。
实验 | 实验现象 | 实验分析、结论 |
A | 剧烈反应,急速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
B | 产生气泡,速率迅速减慢,随后反应几乎停止 | 无法持续产生CO2,不能用于实验室制取CO2 |
C | ________________ | ②____________________ |
(2)根据探究结论,适合在实验室制取二氧化碳的反应原理为______ (用文字表达式表示)。
(3)分析:实验室不能用实验B制取二氧化碳的原因是_________。
【拓展与迁移】(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等。请你再写出一种需要考虑的因素:___________。
(2)以下是某研究小组探究影响反应速率部分因素的相关实验数据。
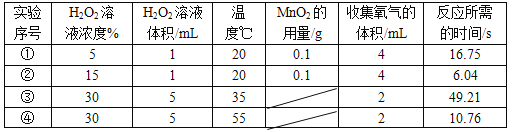
通过实验①和②对比可知,化学反应速率与__________有关;
从实验③和④对比可知,化学反应速率与温度的关系是:__________。
【答案】 反应物种没有碳元素 产生大量平稳的气泡 反应速率适中,气体便于收集 略 B中生成的物质覆盖在碳酸钙表面阻止反应进行 反应装置简约(或反应条件易控或反应原料价廉等)合理的给分 溶液的浓度 温度越高反应速度越快
【解析】【方案设计】据质量守恒定律可知反应前后元素种类不变,不能选用稀硫酸、氯化钙反应制得CO2,因为反应物中没有碳元素;【实验与结论】C现象:产生气泡,速率适中,反应能持续进行,结论:能用于实验室制取CO2。【拓展与迁移】(1)制取气体需要考虑的因素还有:收集的气体是否较纯、实验方案是否节能、是否污染环境,产率高低、反应装置简约(或反应条件易控或反应原料价廉等)等;通过实验①和②对比可知,化学反应速率与溶液的浓度有关,浓度越高,反应越快;从实验③和④对比可知,化学反应速率与温度的关系是:温度越高,反应速率越快。

 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案