题目内容
【题目】硫酸是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼以及染料等工业中 [化学式为:H2SO4]。请回答:(写出(2).(3).(4)的计算过程)
(1) 硫酸中氢、硫、氧三种元素的原子个数比___________________
(2) 硫酸中氢、硫、氧三种元素的质量比为_____________?
(3) 硫酸中硫元素的质量分数是__________?(精确到0.1%)
(4) 196g硫酸中硫元素的质量是__________?
【答案】 2:1:4 1:16:32 32.7% 64g
【解析】(1)1个硫酸分子是由2个氢原子、1个硫原子和4个氧原子构成的,则硫酸中氢、硫、氧三种元素的原子个数比是2:1:4;(2)硫酸中氢、硫、氧三种元素的质量比为(1×2):32:(16×4)=1:16:32;(3)硫酸中氧元素的质量分数=![]() ×100%≈32.7%;(4)196克硫酸中含有硫元素的质量为196g×
×100%≈32.7%;(4)196克硫酸中含有硫元素的质量为196g×![]() ×100%=64g。
×100%=64g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,办法如下:取用8g石灰石样品,把80g稀盐酸分4次加入样品,充分反应后把剩余固体洗涤、干燥、称重,所得数据见下表(已知石灰石样品中的杂质不溶于水,也不与盐酸反应)。
序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
第1次 | 20 | 6.0 |
第2次 | 20 | m |
第3次 | 20 | 2.0 |
第4次 | 20 | 1.2 |
请计算:
(1)表格中m的数值为_______ (1分)
(2)样品中碳酸钙的质量为_______克(1分)
(3)8g石灰石样品中的碳酸钙完全反应,生成二氧化碳_________克?(根据化学方程式计算,过程要规范,结果准确到0.1克,2分)
【题目】某实验小组的同学用氯化钙粉末、碳酸钠粉末、粒状大理石、稀盐酸、稀硫酸这几种药品,探究哪两种药品适合在实验室制取CO2。请你参与下列的探究并回答问题。
【资料卡片】硫酸钙微溶于水,易在碳酸钙表面形成一层隔膜。
【提出问题】上述的酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】小红认为可选用稀硫酸、氯化钙反应制得CO2,小江认为不可能,小江的理由是_____________。大家经过讨论后,设计了如下三个实验进行对比分析。
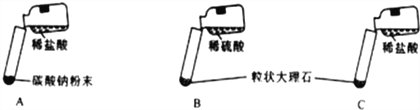
【实验与结论】(1)请你填写实验报告中①、②处的内容。
实验 | 实验现象 | 实验分析、结论 |
A | 剧烈反应,急速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
B | 产生气泡,速率迅速减慢,随后反应几乎停止 | 无法持续产生CO2,不能用于实验室制取CO2 |
C | ________________ | ②____________________ |
(2)根据探究结论,适合在实验室制取二氧化碳的反应原理为______ (用文字表达式表示)。
(3)分析:实验室不能用实验B制取二氧化碳的原因是_________。
【拓展与迁移】(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等。请你再写出一种需要考虑的因素:___________。
(2)以下是某研究小组探究影响反应速率部分因素的相关实验数据。
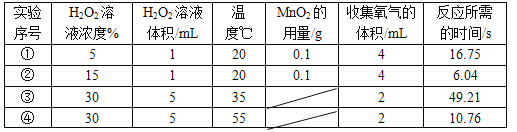
通过实验①和②对比可知,化学反应速率与__________有关;
从实验③和④对比可知,化学反应速率与温度的关系是:__________。
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)请写出镁条燃烧的符号表达式______________________________;
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:_____________________;
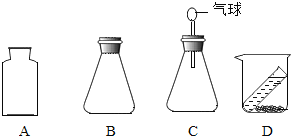
(3)要使该反应能用于验证质量守恒定律,最合理的实验装置是____________(填序号);
(4)小红按右下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
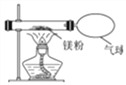
【提出问题】黄色固体是什么?
【查阅资料】(Ⅰ)镁能与二氧化碳反应生成碳和氧化镁;
(Ⅱ)镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
(Ⅲ)氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】
猜想一:固体是碳;
猜想二:固体是氧化镁
猜想三:黄色固体是Mg3N2
【实验探究】固体不可能是碳和氧化镁,原因①______________________;
请设计实验,验证猜想:
实验操作 | 实验现象 | 结论 | |
取少量固体于试管中,加水;将湿润的红色石蕊试纸放在试管口 | ②________________ | 该固体是Mg3N2 | |
【反思与交流】空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:③__________________________________。
