题目内容
【题目】如图为a、b、c三种物质的溶解度曲线:

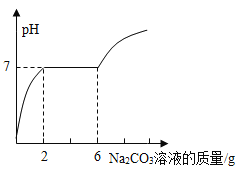
(1)t2℃时将30ga物质加入到50g水中,充分溶解,所得溶液的质量为_____。
(2)a、c两种物质溶解度相等时的温度是_____。
(3)t1℃时a、b两种物质饱和溶液,蒸发掉等质量的水析出晶体量是a____b。(填“>”“<”“=”)
(4)将t2℃时a、b、c三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数大小关系为___。
【答案】75g t1℃ < b>a>c
【解析】
(1)由溶解度曲线可知,物质a在t2℃时,溶解度为50g,含义是该温度下固体物质A在100g水中达到饱和状态时可以溶解50g;若溶剂水只有50g,则A只能被溶解25g就会达到饱和。此时溶液的质量为溶质的质量+溶剂的质量,即50g+25g=75g。故答案为:75g;
(2)a、c两种物质的溶解度相等,则两物质的溶解度的曲线有交点。根据图可知,当t1℃时,a、c两种物质的溶解度曲线产生交点,即t1℃时,两物质的溶解度相等。故答案为:t1℃;
(3)根据图像可知,t1℃时,a、b两种物质的溶解度大小关系为b>a。那么t1℃时,达到饱和状态时,b溶液的溶质质量分数大于a溶液的溶质质量分数。假设现有t1℃时的100g的水,为了使a、b达到饱和状态,加入b的质量比加入a的质量大。则蒸发等质量的水,析出的晶体a的质量比b的质量小。故答案为:<;
(4)在t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c,此时,三种物质的饱和溶液的溶质质量分数大小也为a>b>c。温度下降到t1℃时,a、b仍为饱和溶液,且该温度下,b的溶解度大于a的溶解度,c为不饱和溶液,且溶质质量分数最小。故此时溶质质量分数大小关系为:b>a>c。故答案为:b>a>c。

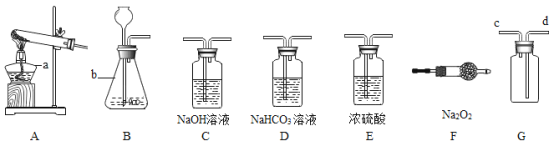
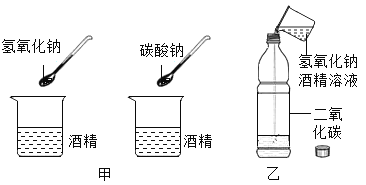
【题目】今年全省统一的化学实验操作考试中,有一题目是鉴别澄清石灰水和氢氧化钠溶液。实验考试中小苗等几位同学碰到了如下问题,请你参与探究:
(提出问题)如何鉴别这两种无色溶液?
(实验方案)小苗等几位同学进行了下图所示的实验。请你回答下列问题:
(1)C组实验中反应的化学方程式为____;
(2)其中不能达到实验目的的是(填字母)____;
(3)实验结束后,小苗同学将D组的两支试管中的废液倒入同一个干净的烧杯中,并将废液进行过滤,同学们对滤液成分进行了探究。
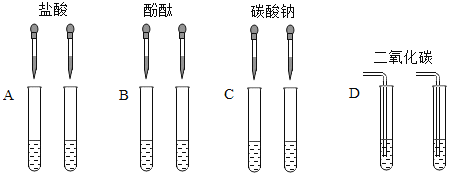
(提出问题)滤液中除水外还含有哪些物质?
(查阅资料)氯化钙溶液呈中性;
(猜想假设)a:只含有氢氧化钠;b:只含有碳酸钠;c:含有氢氧化钠和氢氧化钙;
你认为还可能是(写一种猜想)_____
(实验设计)设计一个简单的实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取滤液于试管中,_______ | ______________________ | 猜想正确 |
(反思拓展)
下列实验方法可以区分氢氧化钠和氢氧化钙两种固体的是____(填字母)。
A 放置在空气中 B 观察颜色 C 加水溶解 D 利用溶解性
【题目】某研究性学习小组对中和反应进行探究,请你参与实验
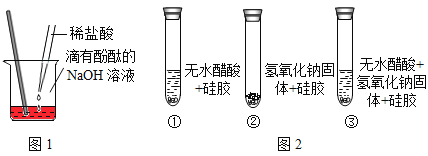
(探究活动1)证明酸和碱发生了反应
小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是____;反应的化学方程式____。
(探究活动2)能否通过证明有水生成来证明其反应的发生?
(设计实验)小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验.
(小资料)a.变色硅胶吸水后由蓝色变为红色;b.无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的实验目的是____;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是____;
(3)能证明酸和碱反应有水生成的现象是_____;
(4)除了上述方法之外,还可以按照下表实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论:
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜 | _____ | 氢氧化钠和盐酸发生了反应 |
【题目】下列客观事实的微观解释正确的是( )
选项 | 客观事实 | 微观解释 |
A | 石墨、金刚石物理性质不同 | 碳原子种类不同 |
B |
|
|
C | 搅拌能加快蔗糖在水中的溶解 | 搅拌使蔗糖分子在水中溶解更多 |
D | 硫酸和盐酸的化学性质相似 | 溶液中存在共同的离子—— |
A.AB.BC.CD.D