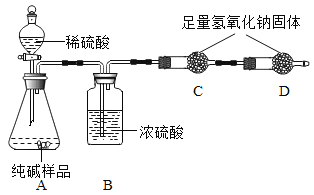
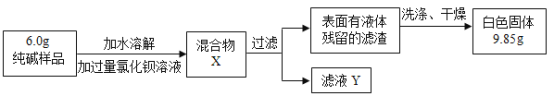
题目内容
【题目】用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液。下列说法中正确的是( )

A. 甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B. 甲实验各步操作中,玻璃棒的作用都是相同的
C. 乙实验若按照②③①的步骤进行操作, 则配制溶液的溶质质量分数偏大
D. 乙实验中,若①所用的烧杯内壁沾有水,对配制溶液的溶质质量分数无影响
【答案】C
【解析】
A、甲实验为粗盐中难溶性杂质的去除,实验步骤是①④⑤,其中去除杂质的关键步骤是过滤。故A错误;
B、甲实验中,①玻璃棒的作用是加快溶解,④玻璃棒的作用是引流,⑤中玻璃棒的作用是防止液体溅出,故B错误;
C、乙实验若按照②③①的步骤进行操作时,量筒中的水是42mL,质量=1g/cm3×42mL=42g,砝码质量是5g,溶质质量分数=![]() ,所以按照②③①的步骤进行操作,则配制的溶液浓度偏大,故C正确;
,所以按照②③①的步骤进行操作,则配制的溶液浓度偏大,故C正确;
D、乙实验中,若①所用的烧杯内壁沾有水时,溶质质量不变,溶液中的溶剂质量增大,质量分数减小,所以若①所用的烧杯内壁沾有水,对配制的溶液浓度有影响。故D错误。故选C。

【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究,请你参与。

(设计实验)第一小组同学共同设计了如图的 A、B 两套装置。你认为合理的是(填编号)______________。
(进行实验)
(数据分析)实验结束后,整理数据如下:(注:集气瓶容积为 100ml)
组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入瓶中水的体积(ml) | 20 | 18 | 19 | 17 | 21 | 19 |
(1)第二小组同学设计了 C 实验装置,优点是:__________________________。
(2)第三小组同学设计了D 实验装置,优点是:__________________________。
【题目】除去物质中的少量杂质,下列实验方法能达到实验目的是( )
实验目的 | 实验方法 | |
A | 除去铜粉中混有的少量碳粉 | 在空气中充分灼烧 |
B | 除去 | 加入过量的铁粉、过滤 |
C | 除去氯化钾中的少量氯酸钾 | 加入少量二氧化锰,并加热 |
D | 除去 | 将气体通过足量灼热的氧化铜 |
A. AB. BC. CD. D