题目内容
如图1是某班同学验证质量守恒定律的实验.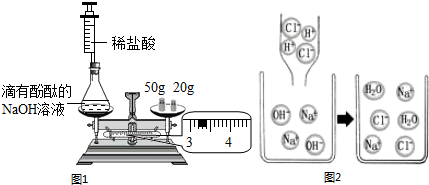
(1)小明用如图1所示装置进行实验.反应前称得左盘内装置及物质总质量为 g,然后注入稀盐酸,充分反应至中性,能证明质量守恒定律的现象是 ;
上述实验向氢氧化钠溶液中滴加酚酞的目的是
(2)小明用微观示意图来说明上述反应的发生,从图2可以看出,反应前后没有发生变化的微观粒子有哪些 ?
(3)小明在实验过程中意外发现有气泡出现,请你用化学方程式说明原因 .
(4)若上述反应稀盐酸和氢氧化钠溶液恰好完全中和,将该实验中的盐酸换成等质量且等质量分数的稀硫酸,反应后得到溶液的pH是 7.(填“大于”“小于”“等于”)
(5)把一定量的二氧化碳通入氢氧化钠溶液中,使二氧化碳恰好完全反应.测得反应后碳酸钠溶液的质量为66.6g,若把溶液蒸干可得到15.9g纯净的碳酸钠固体.求氢氧化钠溶液中溶质的质量分数.

(1)小明用如图1所示装置进行实验.反应前称得左盘内装置及物质总质量为
上述实验向氢氧化钠溶液中滴加酚酞的目的是
(2)小明用微观示意图来说明上述反应的发生,从图2可以看出,反应前后没有发生变化的微观粒子有哪些
(3)小明在实验过程中意外发现有气泡出现,请你用化学方程式说明原因
(4)若上述反应稀盐酸和氢氧化钠溶液恰好完全中和,将该实验中的盐酸换成等质量且等质量分数的稀硫酸,反应后得到溶液的pH是
(5)把一定量的二氧化碳通入氢氧化钠溶液中,使二氧化碳恰好完全反应.测得反应后碳酸钠溶液的质量为66.6g,若把溶液蒸干可得到15.9g纯净的碳酸钠固体.求氢氧化钠溶液中溶质的质量分数.
考点:质量守恒定律及其应用,有关溶质质量分数的简单计算,中和反应及其应用,溶液的酸碱性与pH值的关系,根据化学反应方程式的计算
专题:溶质质量分数与化学方程式相结合的计算,化学用语和质量守恒定律,常见的酸 酸的通性
分析:(1)化学反应遵循质量守恒定律;
氢氧化钠溶液显碱性,能使酚酞试液变红色,滴加稀盐酸时,氢氧化钠能和稀盐酸反应生成氯化钠和水,氯化钠溶液显中性,稀盐酸显酸性,都不能使酚酞试液变色;
(2)氢氧化钠和稀盐酸反应属于中和反应,其实质是氢离子和氢氧根离子结合生成水;
(3)氢氧化钠溶液能够吸收空气中的二氧化碳,并且氢氧化钠能和二氧化碳反应生成碳酸钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
(4)根据反应的化学方程式及其反应物、生成物之间的质量比,可以判断溶液的酸碱性;
(5)根据碳酸钠的质量可以计算氢氧化钠的质量和二氧化碳的质量,进一步可以计算氢氧化钠溶液中溶质的质量分数.
氢氧化钠溶液显碱性,能使酚酞试液变红色,滴加稀盐酸时,氢氧化钠能和稀盐酸反应生成氯化钠和水,氯化钠溶液显中性,稀盐酸显酸性,都不能使酚酞试液变色;
(2)氢氧化钠和稀盐酸反应属于中和反应,其实质是氢离子和氢氧根离子结合生成水;
(3)氢氧化钠溶液能够吸收空气中的二氧化碳,并且氢氧化钠能和二氧化碳反应生成碳酸钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
(4)根据反应的化学方程式及其反应物、生成物之间的质量比,可以判断溶液的酸碱性;
(5)根据碳酸钠的质量可以计算氢氧化钠的质量和二氧化碳的质量,进一步可以计算氢氧化钠溶液中溶质的质量分数.
解答:解:(1)反应前称得左盘内装置及物质总质量为:50g+20g+3.2g=73.2g;
充分反应至中性,能证明质量守恒定律的现象是托盘天平仍然平衡;
上述实验向氢氧化钠溶液中滴加酚酞的目的是验证氢氧化钠和稀盐酸发生了化学反应.
故填:73.2;托盘天平仍然平衡;验证氢氧化钠和稀盐酸发生了化学反应.
(2)从图2可以看出,反应前后没有发生变化的微观粒子是Cl-和Na+.
故填:Cl-和Na+.
(3)小明在实验过程中意外发现有气泡出现,可能是氢氧化钠溶液吸收了空气中的二氧化碳,氢氧化钠和二氧化碳反应生成了碳酸钠,碳酸钠和稀盐酸反应生成了二氧化碳,因此有气泡产生,碳酸钠和稀盐酸反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(4)氢氧化钠和稀盐酸反应的化学方程式及其氢氧化钠和氯化氢的质量比为:NaOH+HCl═NaCl+H2O,
40 36.5
氢氧化钠和稀硫酸反应的化学方程式及其氢氧化钠和硫酸的质量比为:2NaOH+H2SO4═Na2SO4+2H2O,
80 98
由反应物和生成物的质量比可知,若上述反应稀盐酸和氢氧化钠溶液恰好完全中和,将该实验中的盐酸换成等质量且等质量分数的稀硫酸,氢氧化钠过量,反应后得到溶液显碱性,溶液的pH大于7.
故填:大于.
(5)设氢氧化钠的质量为x,二氧化碳的质量为y,
2NaOH+CO2═Na2CO3+H2O,
80 44 106
x y 15.9g
=
=
,
x=12g,y=6.6g,
氢氧化钠溶液的质量为:66.6g-6.6g=60g,
则氢氧化钠溶液中溶质的质量分数为:
×100%=20%,
答:氢氧化钠溶液中溶质的质量分数为20%.
充分反应至中性,能证明质量守恒定律的现象是托盘天平仍然平衡;
上述实验向氢氧化钠溶液中滴加酚酞的目的是验证氢氧化钠和稀盐酸发生了化学反应.
故填:73.2;托盘天平仍然平衡;验证氢氧化钠和稀盐酸发生了化学反应.
(2)从图2可以看出,反应前后没有发生变化的微观粒子是Cl-和Na+.
故填:Cl-和Na+.
(3)小明在实验过程中意外发现有气泡出现,可能是氢氧化钠溶液吸收了空气中的二氧化碳,氢氧化钠和二氧化碳反应生成了碳酸钠,碳酸钠和稀盐酸反应生成了二氧化碳,因此有气泡产生,碳酸钠和稀盐酸反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(4)氢氧化钠和稀盐酸反应的化学方程式及其氢氧化钠和氯化氢的质量比为:NaOH+HCl═NaCl+H2O,
40 36.5
氢氧化钠和稀硫酸反应的化学方程式及其氢氧化钠和硫酸的质量比为:2NaOH+H2SO4═Na2SO4+2H2O,
80 98
由反应物和生成物的质量比可知,若上述反应稀盐酸和氢氧化钠溶液恰好完全中和,将该实验中的盐酸换成等质量且等质量分数的稀硫酸,氢氧化钠过量,反应后得到溶液显碱性,溶液的pH大于7.
故填:大于.
(5)设氢氧化钠的质量为x,二氧化碳的质量为y,
2NaOH+CO2═Na2CO3+H2O,
80 44 106
x y 15.9g
| 80 |
| x |
| 44 |
| y |
| 106 |
| 15.9g |
x=12g,y=6.6g,
氢氧化钠溶液的质量为:66.6g-6.6g=60g,
则氢氧化钠溶液中溶质的质量分数为:
| 12g |
| 60g |
答:氢氧化钠溶液中溶质的质量分数为20%.
点评:化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列变化一定发生了化学变化的是( )
| A、爆炸 | B、发光 | C、燃烧 | D、放热 |

 实验室需要质量分数为10%的NaCl溶液,配制质量分数为5%的氯化钠溶液.
实验室需要质量分数为10%的NaCl溶液,配制质量分数为5%的氯化钠溶液.
 如图是市售某牙膏的部分说明.其主要成分是单氟磷酸钠(Na2PO3F),它是牙膏的常用添加剂,实验表明,单氟磷酸钠的质量分数达到0.76%--0.80%时,防龋齿效果较好.(②③小题计算结果精确到0.01%)
如图是市售某牙膏的部分说明.其主要成分是单氟磷酸钠(Na2PO3F),它是牙膏的常用添加剂,实验表明,单氟磷酸钠的质量分数达到0.76%--0.80%时,防龋齿效果较好.(②③小题计算结果精确到0.01%)