题目内容
【题目】实验室开放日,小红同学做了镁条在空气中燃烧的实验,发现产物中除了有大量白色固体外,还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①镁与氧气反应发出耀眼白光,放出热量,冒大量白烟;
②镁能与氮气在点燃的条件下剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想(请填写下列表格)
实验操作 | 实验现象及结论 |
【反思与交流】
①小红通过查阅资料知道镁条还可以与氮气反应,请你帮助小红同学写出此反应的化学方程式:________________________。
②空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释:______________________________。
③小红同学对镁条燃烧实验中各物质的质量进行了研究,反应前称得镁条的质量为M1,燃烧后所产生的白色固体氧化镁的质量为M2(忽略镁条与氮气反应的影响)。小红同学根据质量守恒定律,推测M1一定要小于M2,但是,称量后比较的实际结果是M1反而大于M2,请你帮助他分析其可能的原因是:_________________________。
【答案】【实验探究】请设计实验,验证猜想(请填写下列表格)
实验操作 | 实验现象及结论 |
取少量黄色粉末放入试管中,加入适量水,然后将湿润的红色石蕊试纸伸入试管内,观察现象。 | 若试纸变蓝,则黄色固体是Mg3N2 |
【反思与交流】
①3Mg+N2![]() Mg3N2;
Mg3N2;
②因为氧气的化学性质比氮气活泼;
镁燃烧生成的氧化镁有一部分以白烟的形式,逸散到空气中去了。
【解析】试题分析:【实验探究】猜想可根据资料③来设计;
【反思与交流】
①由资料②可得应为3Mg+N2![]() Mg3N2;
Mg3N2;
②说明镁与氧气反应的量更多,是因为氧气的化学性质比氮气活泼;只能是有部分生成物逸走,即镁燃烧生成的氧化镁有一部分以白烟的形式,逸散到空气中去了。

【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
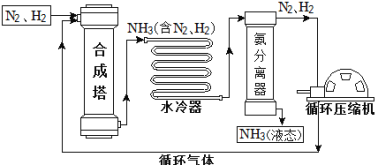
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的符号表达式是: ,属于 (填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于 (填“纯净物”或“混合物”)。
(3)中生产过程中可重复使用的物质是 (填化学式)。
(4)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,欲将NH3与N2、H2分离,最好将温度控制在 之间。
(5)下图是合成塔中发生反应的微观粒子示意图:
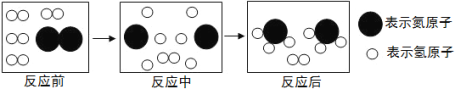
由图可知两种反应物N2与H2的分子个数比为__________;
该反应中的最小粒子是 (填写化学符号)。