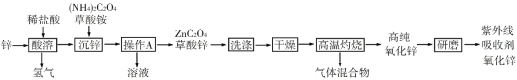
题目内容
【题目】把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示:
第一次 | 第二次 | 第三次 | |
氧气的质量(g) | 3 | 4 | 6 |
SO2的质量(g) | 6 |
请回答下列问题:
(1)写出此反应的化学方程式:_____;
(2)第一次实验中参加反应的硫、氧气和生成二氧化硫的质量之比是_____;
(3)通过计算,第二次实验生成二氧化硫的质量为_____;
(4)第三次生成的二氧化硫的质量为_____。
【答案】![]() 1:1:2 8g 8g
1:1:2 8g 8g
【解析】
(1)硫与氧气反应生成了二氧化硫,该反应的化学方程式为:![]() ;
;
(2)硫燃烧的化学方程式及其质量关系为:![]()
由以上质量关系可知,参加反应的硫、氧气与生成的二氧化硫的质量比是32:32:64=1:1:2;
(3)第二次实验中,当氧气质量是4g时,恰好和4g硫反应生成8g二氧化硫,即生成二氧化硫的质量是8g;
(4)第三次实验中,氧气过量,4g硫完全燃烧生成二氧化硫的质量是8g。

【题目】水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)“生命吸管”(如右图)是一种可以随身携带的小型水净化器,里面装有网丝、注入了活性炭和碘的树脂等。其中活性炭起到________和过滤的作用。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为________。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为________g。
(4)根据下表回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
①60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是________溶液。
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法正确的是________(填字母序号)。
A.溶质的质量不变
B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变
D.可升高温度或增加溶剂
【题目】溶液在生命活动和生产、生活中都起到十分重要的作用,
(1)食盐、蔗糖、花生油分别加入水中,不能形成溶液的是_____。
(2)t℃时向质量均为50g的4份水中分别加入一定量的KNO3固体,充分搅拌。加入KNO3的质量与所得溶液的质量如下表:
实验编号 | a | b | c | d |
加入KNO3固体的质量 | 45 | 50 | 55 | 60 |
所得溶液的质量 | 95 | 100 | 105 | 105 |
①实验a、b、c、d中,有未被溶解的KNO3固体的实验是_____(填写实验编号)。
②t℃时KNO3的溶解度是_____.
③实验所得溶液中质量分数大小关系为:a<b_____c_____d.
④不改变温度,把实验b所得溶液变为质量分数20%,可以采取的操作是_____
(3)向一定量澄清的石灰水中加入少量生石灰,溶液立即变浑浊,可能的原因是_____
A 原石灰水已经饱和,生石灰与水反应的产物不能继续溶解
B 生石灰与水反应放热,溶液温度升高,溶质的溶解度降低
C 空气中的二氧化碳与石灰水反应生成了难溶物质
D 生石灰与水反应消耗了水,溶剂减少,有溶质析出