题目内容
【题目】水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)“生命吸管”(如右图)是一种可以随身携带的小型水净化器,里面装有网丝、注入了活性炭和碘的树脂等。其中活性炭起到________和过滤的作用。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为________。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为________g。
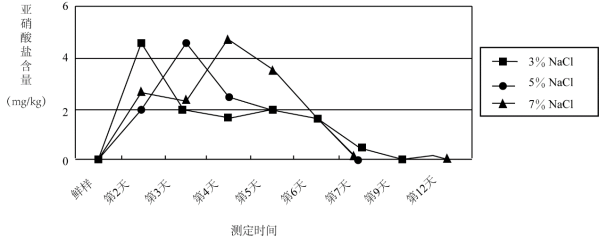
(4)根据下表回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
①60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是________溶液。
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法正确的是________(填字母序号)。
A.溶质的质量不变
B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变
D.可升高温度或增加溶剂
【答案】
【解析】
(1)根据活性炭的作用回答;
(2)硝酸钾溶液中溶质是硝酸钾;
(3)根据稀释前后溶质的质量不变进行解答;
(4)根据饱和溶液的概念及饱和溶液、不饱和溶液的相互转化解答.
解:(1)活性炭可吸附异味和色素、有毒气体,故答案为吸附;
(2)被溶解的是溶质,硝酸钾溶液中溶质是硝酸钾,故答案为硝酸钾或KNO3;
(3)溶液稀释前后溶质的质量不变.
设加入水的质量是X.
(300g×25%)=(300g+x)×15%
x=200g
故答案为200g;
(4)①60℃时,氯化钠的溶解度是37.3g,氯化铵的溶解度是55.2g,即100g水中最多溶解37.3g氯化钠,100g水中最多溶解55.2g氯化铵,所以形成的溶液氯化钠溶液是饱和溶液,氯化铵溶液是不饱和溶液,故答案为NaCl;
②A、既然剩余固体溶解,所以溶质的质量增加,故错误;
B、升高温度不能形成氯化钠的不饱和溶液,加入水,溶质的质量 不变,溶液的质量增加,质量分数一定减小,故正确;
C、溶质质量增加,溶液质量一定增加,故错误;
D、要使溶液中的溶质继续溶解,可采取增加溶剂的方法,升高温度不能让食盐水变不饱和,故错误.
故选B.

【题目】下图表示部分元素的离子结构示意图和元素周期表的一部分。请回答:
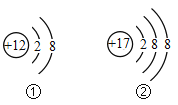
1 H 氢 1.008 | ||||||
8 O 氧 16.00 | 9 F 氟 19.00 | |||||
13 Al 铝 26.98 | 17 Cl 氯 35.45 | |||||
(1)写出图①所表示的离子符号___________;图①和图②所表示的离子形成化合物的化学式___________。
(2)从表中查出铝元素的相对原子质量为___________。
(3)在元素周期表中氟元素与氯元素位于同一纵行的原因是_________。
(4)表中原子序数为1、8的两种元素的常见单质反应的化学方程式为_________。
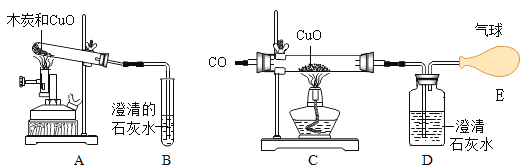
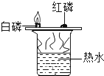
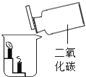
【题目】根据下图所示实验分析得出的结论中,不正确的是( )
|
|
|
|
A.甲烷燃烧生成二氧化碳和水 | B.铁能在氧气中燃烧 | C.白磷的着火点比红磷的低 | D.二氧化碳的密度比空气大,不燃烧也不支持燃烧 |
A. A B. B C. C D. D
【题目】把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示:
第一次 | 第二次 | 第三次 | |
氧气的质量(g) | 3 | 4 | 6 |
SO2的质量(g) | 6 |
请回答下列问题:
(1)写出此反应的化学方程式:_____;
(2)第一次实验中参加反应的硫、氧气和生成二氧化硫的质量之比是_____;
(3)通过计算,第二次实验生成二氧化硫的质量为_____;
(4)第三次生成的二氧化硫的质量为_____。