题目内容
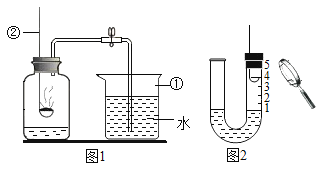
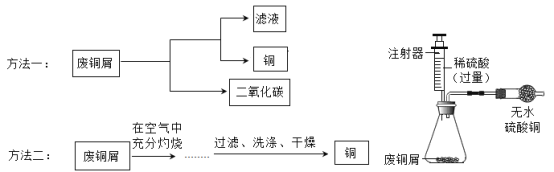
【题目】为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放人试管,用橡皮塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如下图的实验装置。假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
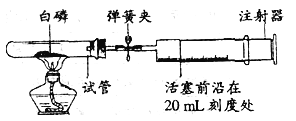
(1)实验前,打开弹簧夹,将注射器活塞前沿从20 ml刻度处推至15 mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明_________________;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为____________________;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为____________________。
【答案】(1)装置的气密性好 (2)白磷燃烧,产生白烟,活塞前沿约在12ml的刻度线上
(3)白磷燃烧,产生白烟,活塞先向右移动,最终稳定在约8ml的刻度线上
【解析】
试题分析:(1) 为确保实验成功,一定要保证装置不漏气,故实验前,打开弹簧夹,将注射器活塞前沿从20 ml刻度处推至15 mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明装置的气密性好
(2) 若先夹紧弹簧夹,那么空气的总体积只有试管内的40mL,那么白磷燃烧消耗的氧气体积为40mL×1/5=8mL,故燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为:白磷燃烧,产生白烟,活塞前沿约在12ml的刻度线上
(3) 若不使用弹簧夹,那么空气的总体积除了试管内的40mL,还得加上注射器内的20mL,那么白磷燃烧消耗的氧气体积为(40mL+20mL)×1/5=12mL,GU 充分反应直至燃烧结束,试管冷却。可观察到的现象为:白磷燃烧,产生白烟,活塞先向右移动,最终稳定在约8ml的刻度线上

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究.
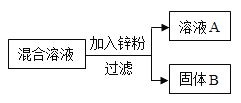
(提出问题)固体B中的成分可能有哪些?
(作出猜想)甲同学:只有Ag
乙同学:Zn、Ag
丙同学:Cu、Ag
请写出你的一种猜想(1)______
(表达交流)写出甲同学猜想的理由(2)______
(反思评价)请你评价乙同学的猜想(3)______
(实验探究)想证明自己的猜想正确
实验步骤 | 现象 | 由此确定固体B的成分写出反应的化学方程式 |
取少量固体B,滴加(4)______ | 有气泡产生 | (5)______ |
在得出固体B的成分后,也确定了液体A的成分,液体A中含有的物质有(化学式)(6)______.