题目内容
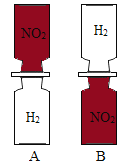
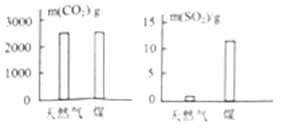
【题目】把分别充满红棕色的二氧化氮(NO2)气体和无色的氢气(H2)的集气瓶按照下图A、B两种方式放置,然后把两瓶中间的玻璃片抽走,使两瓶口密合在一起(不要振荡),可观察到A中两瓶气体的颜色很快趋于一致(两气体不反应),而B中需要很长时间才能达到同样的效果。
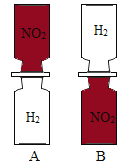
由此可以得出的结论有:
(1)______________。
(2)______________。
(3)______________。
【答案】二氧化氮(NO2)气体的密度比氢气(H2)的密度大 分子都在不停地运动 分子之间存在一定的间隔
【解析】
因为氢气分子和二氧化氮分子在不断运动,且分子间有间隔,氢气的密度小,向上运动,二氧化氮的密度大,向下运动,所以A瓶中的颜色很快趋于一致,B瓶中的混合较慢是因为氢气密度小,在上面运动,二氧化氮密度大,在下面运动的原因,同时证明分子之间存在一定间隔;由此可以得出的结论有:
(1)二氧化氮(![]() )气体的密度比氢气(
)气体的密度比氢气(![]() )的密度大;
)的密度大;
(2)分子都在不停地运动;
(3). 分子之间存在一定的间隔。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】化学实验是学习化学的基础,请根据下列装置图回答问题。
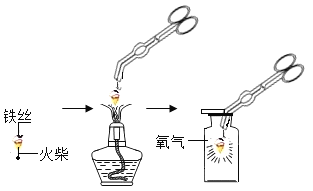
(1)铁丝绕成螺旋状的原因是___________。
(2)小明按图示进行实验时,集气瓶炸裂了,其可能的原因是___________。
(3)图中螺旋状铁丝的末端系一根火柴的作用是_____。
(4)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4 mm)放入氧气中燃烧时的实验现象的记录。请你分析后回答问题:
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时的现象 | 剧烈燃烧,发出耀眼白光,无火星 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 | (未填) |
①你认为表中未填完整的实验现象是__________________。
②造成铁丝在氧气中燃烧时火星四射的主要原因是_______________。