题目内容
【题目】用如图装置在相应条件下完成下列实验。
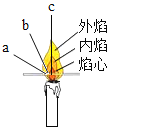
实验一、探究燃烧条件(B中盛木炭粉)
①由A处通N2一段时间后,加热B,B、C无明显变化。
②待B冷却至室温,由A处通入O2一段时间,B、C无明显变化。
③由A处继续通入O2,加热B,木炭粉燃烧,C中溶液变浑浊。
结论:由①、③可知燃烧需要 ;由②、③可知燃烧需要
结论:由①、③可知燃烧需要_________________________; 由②、 ③可知燃烧需要_________________________。
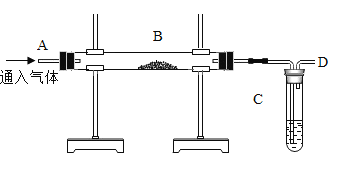
实验二、探究炼铁原理( B中盛氧化铁粉末)
工业上炼铁的原理是利用一氧化碳和氧化铁的反应,某化学兴趣小组利用如图装置进行实验探究,( 已知氢氧化钠溶液不与一-氧化碳反应,能与二氧化碳反应)
请按要求填空:
(1) B处发生的现象是_________________________。
(2)实验过程中,CO的作用有_________________________(填序号)。
①CO气体作为反应物
②实验开始时,排尽装置中的空气,防止加热时发生爆炸
③停止加热后防止C中的溶液倒吸人B中
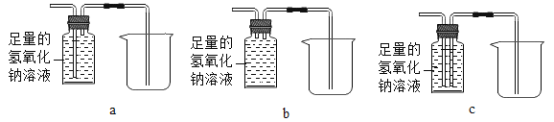
(3)为了回收利用一氧化碳,需除去尾气中的二氧化碳,并将剩余气体收集在集气瓶中,D处可连接下列装置中的___________________( 填序号 )最为合理。
实验三、探究蔗糖的组成(B中盛蔗糖)
[查找资料]绿色植物能进行光合作用,可产生葡萄糖( C6H12O6),葡萄糖进一步转化为蔗糖。
[做出猜想]蔗糖的组成可能含有碳、氢元素或碳、氢、氧三种元素,猜想的依据是_______________。
[实验验证]小组同学将实验一图C装置进行了一些改动, 用来探究蔗糖的组成。实验开始先通入一会儿氮气,然后关闭弹簧夹,再点燃酒精灯给玻璃管加强热。
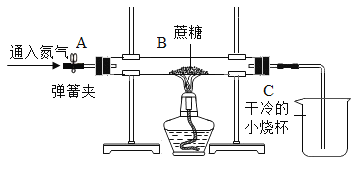
(1)观察到干冷的小烧杯_________________________,说明蔗糖含有氢元素和氧元素。
(2)观察到硬质玻璃管残留有黑色固体,经证明该黑色固体是单质碳。
[实验结论]蔗糖是由碳、氢、氧三种元素组成。
[拓展交流] (1)实验中,先通入一会儿氮气的原因是_________________。
(2)兴趣小组用定量方法准确测量出17.1g蔗糖与足量氧气反应后生成26.4g-二氧化碳及9.9g水,则蔗糖中碳氢元素质量比为_______________;据此可推测蔗糖的化学式为____________(选填字母)。
A C6H5NO2
B C8H18O6
C C12H22O11
【答案】可燃物与氧气接触 温度达到着火点 固体由红色变成黑色 ①②③ c 质量守恒定律 内壁有水珠出现 排尽空气,防止对氢元素、氧元素的探究产生影响 72:11 C
【解析】
实验一、(1)①可燃物在氮气中加热不燃烧,③可燃物在氧气中加热燃烧,由①、③可知燃烧需要可燃物与氧气接触;②可燃物通入氧气未加热不燃烧,③可燃物通入氧气加热燃烧,由②、③可知燃烧需要温度达到着火点;结论:由①、③可知燃烧需要可燃物与氧气充分接触;由②、 ③可知燃烧需要可燃物与氧气充分接触;
实验二、工业上炼铁的原理是利用一氧化碳和氧化铁在高温条件下反应生成铁和二氧化碳;
(1) B处发生的反应的现象是固体由红色变成黑色;
(2)实验过程中,CO的作用:
①CO气体作为反应物和氧化铁反应,选项正确;
②加热可燃性气体与空气的混合物易发生爆炸,实验开始时,排尽装置中的空气,防止加热时发生爆炸,选项正确;
③停止加热后要继续通入一氧化碳,防止生成的铁再被氧化,B中压强不减少, C中的溶液不会倒吸人B中,选项正确;故选①②③。
(3)a中气体从长管进入溶液中被溶液吸收,然后从短管中排除广口瓶,选项错误;b中两个管都短,即不能充分吸收,也不能收集,选项错误;
c中在二氧化碳被吸收的同时,一氧化碳保存在集气瓶内,排出去的是液体,能回收利用一氧化碳,除去尾气中的二氧化碳,选项正确;故选c;
实验三、[做出猜想]根据质量守恒定律,化学变化中元素的种类不发生改变。蔗糖的组成可能含有碳、氢元素或碳、氢、氧三种元素。
(1)观察到干冷的小烧杯内壁有水珠出现,说明蔗糖含有氢元素和氧元素;
[拓展交流](1)实验中,先通入一会儿氮气的原因是排尽空气(氧气、水蒸气),防止对氢元素、氧元素的探究产生影响;
(2)据质量守恒定律可知反应前后元素的种类、质量不变,用定量方法准确测量出17.1g蔗糖与足量氧气反应后生成26.4g-二氧化碳及9.9g水,则蔗糖中碳的质量为:26.4g×![]() =7.2g; 氢元素质量为:9.9g×
=7.2g; 氢元素质量为:9.9g×![]() =1.1g;碳、氢元素的质量比为7.2g:1.1g=72:11;据此可推测蔗糖中氧元素质量为17.1g-7.2g-1.1g=8.8g,蔗糖中碳、氢、氧的原子个数比为:
=1.1g;碳、氢元素的质量比为7.2g:1.1g=72:11;据此可推测蔗糖中氧元素质量为17.1g-7.2g-1.1g=8.8g,蔗糖中碳、氢、氧的原子个数比为:![]() =12:22:11,化学式为C12H22O11,故选C。
=12:22:11,化学式为C12H22O11,故选C。

 53天天练系列答案
53天天练系列答案【题目】工业上用电解饱和食盐水的方法来制取氢氧化钠等化学物质。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
溶解度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
NaOH | 42 | 51 | 109 | 119 | 129 | 145 | 174 | 299 | 314 | 329 | 347 | |
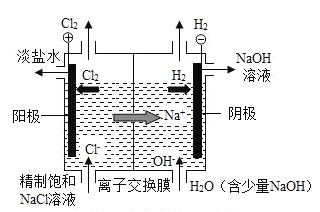
(1)离子交换电解槽中阴极部分得到的产品是 NaOH 和_____。
(2)在电解槽的阳极部分,饱和食盐水变成淡盐水的原因是_____减少(填“溶质”或“溶剂”)。除去淡盐水中的溶解的少量 Cl2,有关反应的化学方程式是Na2SO3+Cl2+H2O=Na2SO4+2X.其中 X 的化学式是_____。
(3)20℃时,50g 水中最多溶解 NaOH 的质量是_____g。
(4)从含有少量 NaCl 杂质的 NaOH 固体中获取纯净 NaOH 固体的方法是:溶解→_____结晶→_____→洗涤→干燥。
【题目】碱石灰是实验室常用的干燥剂。实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易吸收空气中的水蒸汽和CO2。
(提出问题)实验室中久置的碱石灰样品的成分是什么?
(查阅资料)CaCl2溶液呈中性。
(进行猜想)久置碱石灰样品中可能含有CaO、NaOH、Ca(OH)2、Na2CO3、CaCO3中的两种或两种以上成分。样品中可能含有Ca(OH)2、Na2CO3的原因是(请用化学方程式表示)_____、_____。
(实验过程)某实验小组对久置碱石灰的成分进行实验,以下是实验报告的一部分,请你用所学知识分析并填空。
操作 | 现象 | 结论 | |
(1)取一定量碱石灰样品于小烧杯,加入足量水,搅拌 | 形成悬浊液 | ||
(2)将(1)所得混合物过滤,在滤渣中加入稀盐酸 | 有气泡产生 | ①滤渣中一定含有_____ | |
将所得溶液分为三等份 | (3)第一份滤液中通入足量的CO2. | 无明显现象 | ②滤液中一定不含_____、_____ ③滤液中一定含_____ |
(4)第二份滤液中滴入足量澄清石灰水 | 有沉淀产生 | ||
(5)第三份滤液中滴入过量的CaCl2溶液,静置后,在上层清液中滴加酚酞试液. | 产生白色沉淀,酚酞试液不变色 | ||
(实验结论)根据上述实验分析得出结论:该碱石灰样品的组成为_____(填化学式).