题目内容
【题目】工业上用电解饱和食盐水的方法来制取氢氧化钠等化学物质。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
溶解度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
NaOH | 42 | 51 | 109 | 119 | 129 | 145 | 174 | 299 | 314 | 329 | 347 | |
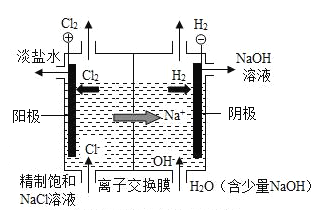
(1)离子交换电解槽中阴极部分得到的产品是 NaOH 和_____。
(2)在电解槽的阳极部分,饱和食盐水变成淡盐水的原因是_____减少(填“溶质”或“溶剂”)。除去淡盐水中的溶解的少量 Cl2,有关反应的化学方程式是Na2SO3+Cl2+H2O=Na2SO4+2X.其中 X 的化学式是_____。
(3)20℃时,50g 水中最多溶解 NaOH 的质量是_____g。
(4)从含有少量 NaCl 杂质的 NaOH 固体中获取纯净 NaOH 固体的方法是:溶解→_____结晶→_____→洗涤→干燥。
【答案】H2 溶质 HCl 54.5 降温 过滤
【解析】
(1)从离子交换膜电解槽示意图中可以看出,阴极部分得到的产品是 NaOH 溶液和氢气;
(2)饱和食盐水变成淡盐水,溶液变稀,是因为溶质减少。而溶剂减少不会使溶液变稀。根据质量守恒定律,反应前后原子种类、数量不变,根据反应方程式Na2SO3+Cl2+H2O=Na2SO4+2X,可知一个X含有一个氢原子、一个氯原子,故X 的化学式是HCl。
(3)由溶解度表可知,20℃时,NaOH 的溶解度为 109g,即 20℃时 100g 水中最多溶解 NaOH 固体 109g。所以 20℃时,50g 水中最多能溶解 50× 109 =54.5g 的 NaOH。
(4)由溶解度表可知,NaOH 的溶解度随温度升高而增大,且受温度影响较明显,属于陡升型,所以要采用降温结晶的方法提纯;将析出的晶体和母液分离的操作是过滤。