题目内容
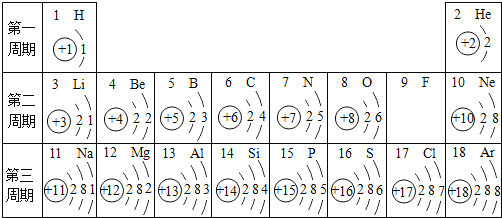
【题目】如图是盐酸性质的知识归纳,下列表达不正确的是( )
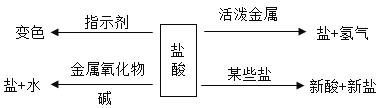
A.若盐为AgNO3溶液,则反应中有白色沉淀生成
B.若碱为NaOH的溶液,可以在溶液中滴加酚酞溶液,证明两者发生了中和反应
C.若金属氧化物为铁锈的主要成分,可以利用盐酸与金属氧化物反应的这一性质,除去铁锈
D.若金属为Mg和Zn,将过量的两种金属分别与等质量等浓度的一定量的稀盐酸完全反应,Mg产生的H2多
【答案】D
【解析】
图中内容对盐酸的化学性质进行了归纳,也是常见酸的通性。利用这些通性可以判断某些反应能否发生。
A. 若盐为AgNO3溶液,盐酸与其反应会生成氯化银白色沉淀。故A不符合题意;
B. 若碱为NaOH的溶液,盐酸与氢氧化钠反应没有明显现象,在氢氧化钠溶液中滴加酚酞溶液(遇碱变红),再加入盐酸后,红色褪去,通过酚酞的颜色变化证明两者发生了中和反应。故B不符合题意;
C. 若金属氧化物为铁锈的主要成分,盐酸与铁锈发生反应![]() ,使铁锈(固体)变成溶液(液体)而除去,
,使铁锈(固体)变成溶液(液体)而除去,
所以可以利用盐酸与金属氧化物反应的这一性质,除去铁锈。故C不符合题意;
D. 根据质量守恒定律,氢气中的氢元素全部来自硫酸溶质,金属不含氢元素,两种金属都是过量的,稀盐酸是等质量等浓度的,最后酸全部参加反应,所以酸中的氢元素的质量相等,产生的氢气质量也相等。故D符合题意。
故选D。

【题目】化学就在我们身边,请用所学的化学知识填空。
(1)从H、O、C、Cl、Ca五种元素中,选择适当的元素组成符合下列要求的物质,并用化学式填空(每空只填一种物质)。
①相对分子质量最小的氧化物是_______;
②农业上用来降低土壤酸性的_________;
③可用于金属表面除锈的是____________;
④厨房用的酸性调味品是____________;
⑤最简单的有机物是________。
(2)以下是日常生活中常用各种清洗剂
名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 活氧彩漂 | 污渍爆炸盐 |
产品样式 |
|
|
|
|
|
有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过氧化氢 | 过碳酸钠 |
①使用洗涤灵清洗餐具上的油污,这是因为它具有__________功能。
②清除以下物质,可使用炉具清洁剂的是______________(填字母序号)。
a.铁锈 b.油污 c.水垢
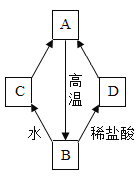
③“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,此反应体现了如图中______________(选填①②③④)性质关系。

④将洁厕灵加入滴有酚酞的炉具清洁剂中,若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_____________________。