题目内容
一同学取来某品牌的钾肥,主要成分硫酸钾,还含少量的氯化钾共200克,投入到908克的氯化钡溶液中恰好完全反应.经过滤后得到硫酸钡沉淀233克和氯化钾的不饱和溶液.请帮他计算:(注明:K2SO4+BaCl2=BaSO4↓+2KCl)
(1)硫酸钾中钾、硫、氧的原子个数比是 ,氯化钾的相对分子质量是 .
(2)200克该品牌的钾肥中硫酸钾的质量是多少?
(3)反应后所得氯化钾不饱和溶液中溶质的质量分数是多少?
(1)2:1:4;74.5 (2)174g (3)20.0%
解析试题分析:(1)硫酸钾的化学式为K2SO4可知硫酸钾中钾、硫、氧的原子个数比=2:1:4;氯化钾的化学式为KCl可知氯化钾的相对分子质量=39+35.5=74.5;故填:2:1:4;74.5;
(2)设200克该品牌的钾肥中硫酸钾的质量是x,生成氯化钾的质量为y.
K2SO4+BaCl2=2KCl+BaSO4↓
174 149 233
x y 233g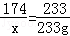
x=174g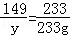
y=149g
答:200克该品牌的钾肥中硫酸钾的质量是174g.
(3)反应后所得氯化钾不饱和溶液中溶质的质量分数是=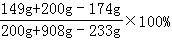 =20.0%
=20.0%
答:反应后所得氯化钾不饱和溶液中溶质的质量分数是20.0%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算;相对分子质量的概念及其计算.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算.在计算(2)时注意,滤渣的质量就是氯化钡与硫酸钾反应生成的硫酸钡沉淀的质量.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
在实验室里,利用下列物质和装置制取气体的方法正确的是
| A.二氧化锰和氯酸钾制取氧气 |
| B.大理石和浓盐酸制取二氧化碳 |
| C.二氧化锰和6%的过氧化氢溶液制取氧气 |
| D.铜和稀硫酸制取氢气 |
实验室用如图所示装置制取和收集氧气,下列说法“不正确”的是( )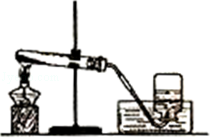
| A.装入药品前先检验装置的气密性 |
| B.试管口处的棉花是用于防止冷凝水回流到试管底部 |
| C.气体集满后,盖好玻璃片,将集气瓶正放在桌面上 |
| D.收集完成后,先把导管移出水面,再熄灭酒精灯 |