题目内容
【题目】在一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )
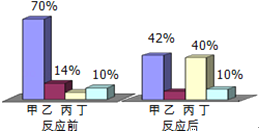
A. 丁是该反应的催化剂
B. 该反应的基本类型是分解反应
C. 参与反应的乙、丙质量比为3︰17
D. 参与反应的甲、丙质量比为7︰10
【答案】C
【解析】
由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了70%-42%=28%,故甲是反应物;同理可以通过图示确定乙的质量分数减少了14%-8%=6%,故乙是反应物;丙的质量分数增加了40%-6%=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。
A、丁的质量分数不变,可能没有参加反应,也可能作该反应的催化剂,故选项说法错误;
B、该反应的反应物为甲和乙,生成物是丙,符合“多变一”的特征,属于化合反应,故选项说法错误;
C、该反应中乙、丙的质量比为6%:34%=3:17,故选项说法正确;
D、该反应中甲、丙的质量比为28%:34%=14:17,故D选项说法错误。
故选:C。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】某实验小组用3克氯酸钾和二氧化锰混合物进行实验,加热该混合物t1时间后(杂质不反应),冷却,称量剩余固体的质量,重复以上操作,依次加热t2、t3、t4时间后测得剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 2.68 | 2.36 | 2.04 | 2.04 |
(1)加热t3时间后氯酸钾是否分解完全?_________(填“是”或“否”)
(2)完全反应后产生氧气的质量为_____________克;
(3)该混合物中氯酸钾的质量为_____?
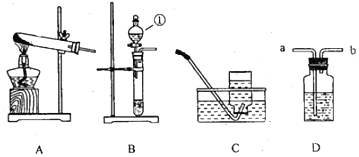
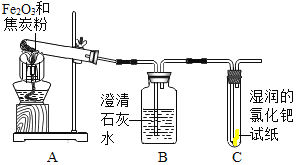
【题目】同学们在学习了焦炭还原氧化铁的反应后,联想到单质碳的一些化学性质,对反应后的气体成份产生了疑问,并对其气体成份进行了如下探究。
(猜想)①气体产物全部是![]() ;
;
②气体产物全部是______。
③气体产物是CO和![]() 的混合物
的混合物
(查阅资料)CO气体能使湿润的黄色氯化钯试纸变蓝色。
(设计实验)根据各自的猜想,他们共同设计了如图的实验装置进行探究。
(现象与分析)
预期的现象 | 相应的结论 |
如果装置B中澄清石灰水变浑浊,装置C无明显现象; | 则猜想①成立 |
如果装置B中澄清石灰水变无明显变化,装置C ______ 。 | 则猜想 ______ 成立 |
如果装置B ______ ,装置C ______ | 则猜想 ______ 成立。 |
(结论)根据实验结果猜想③成立,同学们的疑问是合理的。
(反思)
![]() 同学们对CO产生的原因进行了首先
同学们对CO产生的原因进行了首先![]() 与焦炭反应,生成的其中一种产物和焦炭又发生了化学反应,产生了CO;请你用化学方程式表示生成CO的原因______,______。
与焦炭反应,生成的其中一种产物和焦炭又发生了化学反应,产生了CO;请你用化学方程式表示生成CO的原因______,______。
![]() 根据上述实验,可以得出焦炭具有______性。
根据上述实验,可以得出焦炭具有______性。