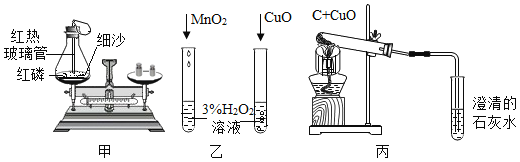
题目内容
【题目】将10g氧化铜粉末加入到100g一定质量分数的稀硫酸中,微热到氧化铜全部溶解,再向溶液中加入ag铁粉,使溶液中的溶质完全反应后,过滤,将滤渣在低温下烘干,得到干燥固体质量仍然为ag,下列分析不正确的是()
A.稀硫酸中溶质质量分数为14%
B.滤渣中一定只含有铜
C.加入铁粉后有红色固体产生,还有少量气泡产生
D.a的取值范围:a>8
【答案】B
【解析】
根据题给信息可知,氧化铜完全参加反应,再加入铁粉,溶液中的溶质完全反应,即铁将硫酸铜完全置换,如果稀硫酸剩余,铁与稀硫酸反应生成硫酸亚铁和氢气,稀硫酸完全反应,铁可能恰好和硫酸铜、稀硫酸完全反应,也可能过量相关的化学方程式为:![]() ;
;![]()
![]()
设与10g氧化铜反应的硫酸的质量为x,消耗的铁的质量为y,生成铜的质量为z。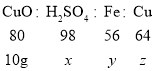
![]() x=12.25g
x=12.25g
![]() y=7g
y=7g
![]() z=8g
z=8g
假设铁完全反应
因为生成的铜为8g,即a=8g,那么加入的铁粉也应是8g,故与氧化铜反应后,稀硫酸一定过量,则与稀硫酸反应的铁粉的质量为8g-7g=1g。设与1g铁粉反应的硫酸的质量为m。
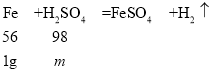
![]() ,解得m=1.75g
,解得m=1.75g
稀硫酸中溶质的质量分数为:![]() =14%。
=14%。
A、稀硫酸中溶质质量分数为14%,此选项正确;
B、由分析可知,滤渣中一定含有铜,可能含有铁,此选项错误;
C、由分析可知,因为100g稀硫酸与10g氧化铜粉末反应时有剩余,所以加入铁粉后,铁先与硫酸铜反应生成铜和硫酸亚铁,后与稀硫酸反应生成硫酸亚铁和氢气,故有红色固体产生,还有少量气泡产生,此选项正确;
D. 由以上的分析可知,铁恰好完全反应后,a=8,铁过量时,a>8,故a的取值范围为a>8,此选项正确。
故选B。

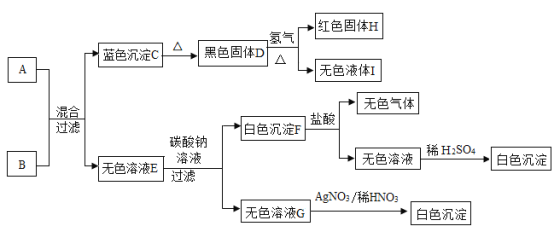
【题目】一包白色粉末A由Na2SO4、NaOH、Ba(OH)2、BaCO3、 MgC12五种物质中的两种或多种混合而成。为探究其组成,进行如下图所示的实验: (假设 实验过程中所发生的反应均恰好完全反应)
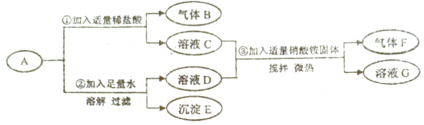
依据实验过程和出现的现象请你回答下列问题:
(1)气体F的化学式是_______。
(2)写出步骤①中生成气体B的化学方程式:______。
(3)在溶液C和溶液G中,一定都存在的阴离子是_____(写离子符号)。
(4)固体混合物A中,肯定不存在的物质有______种。若要进一步推理A的组成,可用溶液D再做实验确定可能含有的物质:
实验操作 | 实验现象 | 实验结论 |
取溶液D少许,滴加Na2SO4溶液,震荡 | 有白色沉淀生成 | ______ |