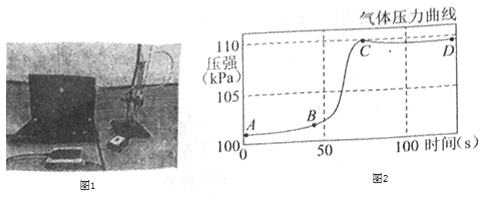
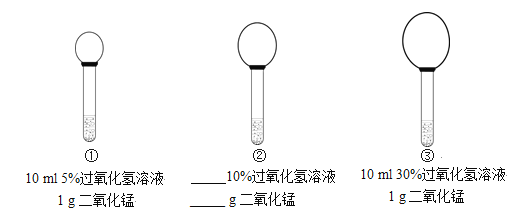
题目内容
【题目】X、Y 两种固体物质的溶解度曲线如右图所示。下列说法正确的是
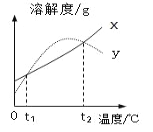
A. t1℃时 X 的饱和溶液升温至 t2℃时仍是饱和溶液
B. 分别将 t1℃时 X、Y 的饱和溶液升温至 t2℃,所得溶液中溶 质的质量分数相等
C. 相同温度时,X 的溶解度一定大于 Y 的溶解度
D. Y 的溶解度随温度的升高而增大
【答案】B
【解析】
A、根据溶解度曲线可知,X的溶解度随温度的升高而增大,t1℃X的饱和溶液升温至t2℃变成不饱和溶液,错误;B、根据溶解度曲线可知,X、Y的溶解度从t1℃升温至t2℃时,溶解度变大,溶质的质量分数不变,t1℃时X、Y溶解度相等,它们的饱和溶液的质量分数相等,分别将t1℃X、Y的饱和溶液升温至t2℃,所得溶液中溶质的质量分数相等,正确;C、根据溶解度曲线可知,相同温度时,X的溶解度不一定大于Y的溶解度,错误;D、根据溶解度曲线可知,Y的溶解度随温度的升高先升高后减少,错误。故选B。

【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。请回答下列问题:
X | Y | ||||||
Z | W | ||||||
(1)X能形成多种单质,写出其中两种单质的名称_____。
(2)Z元素的原子结构示意图是_____。
(3)元素的非金属性为(原子的得电子能力):Y______W(填“大于”或“小于”)。
(4)W位于周期表的_____周期,_____主族,该元素最高价氧化物对应水化物的化学式是_____。(中心元素可用字母W表示)
(5)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用NaOH溶液来“捕捉”CO2,过程如图所示(部分条件及物质未标出)。

请根据“捕捉”CO2过程图回答问题:
①加入A物质的化学式是_____;分离操作Ⅰ的名称是_____。
②可循环利用的B物质中一定含有的物质是_____。
③该过程中还可循环利用的物质是_____。
【题目】化学小组的同学在做镁条在空气中燃烧实验时,发现生成的白色固体中还夹杂着少量的淡黄色的固体。
【提出问题】为什么会生成淡黄色固体?
【查阅资料】记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
小红同学认为不必查阅氯化镁的颜色,理由是:________________________。
【提出猜想】分析资料小红认为淡黄色固体可能是和空气中的__________反应生成的。
【实验探究】小红设计实验来验证自己的猜想,他的方案可能是:__________。
【实验结论】根据小红的实验结果,写出镁条在空气中燃烧的两个化学反应方程式:
①_______________________________; ②______________________________。