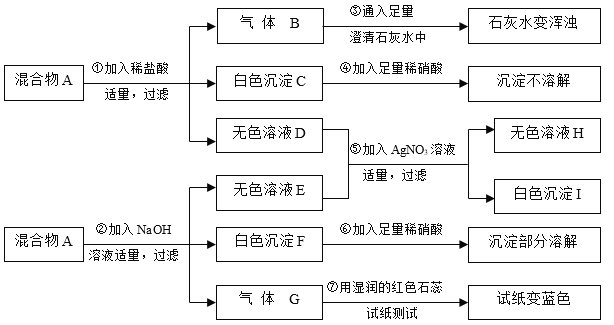
题目内容
【题目】科学家利用新方法设计出超轻铝晶体,全新超轻铝结构未来将广泛应用于研制更轻便的航天飞机和汽车部件等方面。
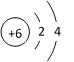
(1)铝是地壳中含量最高的______(填“金属”或“非金属”)元素。铝元素的原子结构示意图如图所示,则铝原子的最外层电子数为_____。容易______(选“失去”或“得到”),形成的离子符号为______。
(2)飞机机身选用铝合金材料制造而不选用纯铝,主要原因是铝合金材料的硬度和强度_____(填“大于”或“小于”)纯铝。
(3)铝制品要比铁更耐腐蚀的原因是(用化学方程式表示)________________________,反应的基本类型为____反应。
(4)对Al、Cu、Ag三种金属的活动性顺序进行探究,下列所选无法达到目的的一组试剂是________(填序号)
A Al、Ag、CuSO4溶液 B AlCl3溶液、Cu、AgNO3溶液
C Al、Cu、稀盐酸、AgNO3溶液 D Cu、Ag、AlCl3溶液
【答案】金属 3 失去 Al3+ 大于 4Al+3O2=2Al2O3 化合 D
【解析】
(1)铝元素是地壳中含量最高的金属元素,故填写:金属;
由铝元素的原子结构示意图可知,铝原子的最外层电子数为3,小于4,易失去最外层3个电子,达到8电子稳定结构,故填写:3;失去;
铝原子失去3个电子,形成带3个正电荷的阳离子即铝离子,由离子的表示方法可得,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故填写:Al3+;
(2)根据合金的特性可知,飞机机身选用铝合金材料制造而不选用纯铝,主要原因是铝合金材料的硬度和强度大于纯铝,故填写:大于;
(3)铝制品要比铁更耐腐蚀的原因是铝常温下与空气中氧气反应生成致密的氧化铝薄膜,阻止内部铝继续反应,化学方程式为:4Al+3O2=2Al2O3,故填写:4Al+3O2=2Al2O3;
铝与氧气反应生成氧化铝,反应物有两种,生成物有一种,符合“多变一”化合反应的特点,基本反应类型为化合反应,故填写:化合;
(4)A、Al、Ag、CuSO4溶液:铝能置换出硫酸铜的铜,说明铝比铜活泼;银不能置换出硫酸铜中的铜,说明银不如铜活泼,可以证明:Al>Cu>Ag,选项说法正确,故不符合题意;
B、Cu、AgNO3、AlCl3溶液:铜不与氯化铝溶液反应,说明铝比铜活泼,但铜能置换出硝酸银的银,说明铜比银活泼,可以证明:Al>Cu>Ag,选项说法正确,故不符合题意;
C、Al、Cu、稀盐酸、AgNO3溶液:铝与稀盐酸反应产生氢气,铜不与稀盐酸反应,说明铝比氢活泼,铜没有氢活泼,即铝比铜活泼,铝和铜都能置换出硝酸银的银,说明银的金属活动性比铝和铜弱,因此,可以证明Al>Cu>Ag,选项说法正确,故不符合题意;
D、Cu和Ag都不能与氯化铝反应,说明铝的金属活动性比银和铜强,但无法说明铜和银的金属活动性强弱,无法对Al、Cu、Ag三种金属的活动性顺序进行探究,选项说法错误,故符合题意,故选D。

【题目】实验探究一:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ① 产生的气体是______ ② 红砖粉末能改变过氧化氢分解速率 |
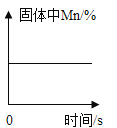
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的_____在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡且______ | 红砖粉末的催化效果没有二氧化锰粉末好 |
【拓展应用】己知CuSO4也可作为过氧化氢分解的催化剂。写出其反应的符号表达式___________________________